【東京医科大学】細胞外アミノアシルtRNA合成酵素は関節リウマチにおいてサイトカインおよびPAD4を放出させることで、自己免疫応答や炎症応答を引き起こす~ブシラミンによる標的アミノアシルtRNA合成酵素を介する抗リウマチ作用~
この研究成果は、2023年7月2日(米国東部時間)のAnnals of the Rheumatic Diseases誌(オンライン版)に掲載されました。
関節リウマチ(Rheumatoid arthritis; RA)は関節に炎症が起こることによって、痛みや腫れが生じる自己免疫疾患の一つです。これまでに、いくつかの抗リウマチ薬が開発されてきましたが、ブシラミン(商品名:リマチル;あゆみ製薬)は日本で開発された抗リウマチ薬として知られています。しかしながらブシラミンの作用機序についてはほとんど解明されていませんでした。
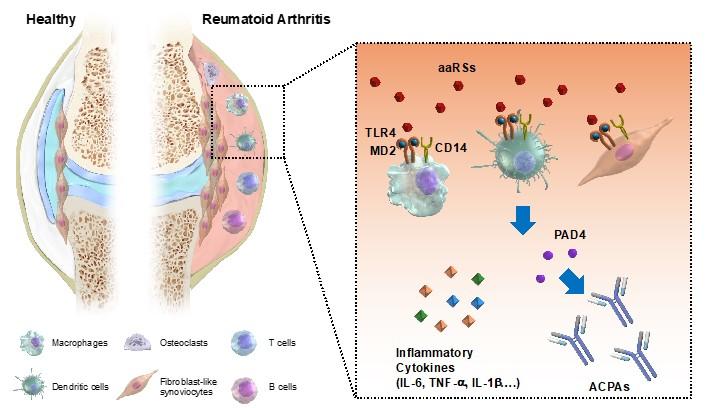
東京医科大学(学長:林由起子/東京都新宿区)医学総合研究所の半田宏兼任教授らの研究グループは、国立国際医療研究センター研究所 肝炎・免疫研究センター 免疫病理研究部 鈴木春巳部長らの研究グループとの共同研究により、アミノアシルtRNA合成酵素(aminoacyl-tRNA synthetases; aaRSs)(注1)がブシラミンの標的タンパクであることを発見しました。RAとaaRSsの関連性について研究を進めたところ、RA患者において血清や滑膜液中にaaRSsが放出されていることを発見し、さらに細胞外aaRSsがアラーミン(注2)として機能することで、マクロファージや樹状細胞からサイトカイン(注3)やProtein Arginine Deiminase 4 (PAD4) (注4)を放出させていることを明らかにしました。また、ブシラミンはaaRSsによるサイトカイン産生誘導を阻害することも明らかとなり、ブシラミンは細胞外に放出されたaaRSsと結合し、アラーミンとしての機能を阻害することで、抗リウマチ薬の機能を発揮している可能性が示唆されました。さらに、アラーミンとしてのaaRSsの機能を抑制する阻害ペプチドの開発にも成功しており、この阻害ペプチドが関節リウマチのマウスモデルにおいて治療効果があることが示されました。今回の研究成果により、aaRSsが細胞外に放出されアラーミンとして機能することで、RAの発症や病態の悪化に大きく関与していることが示されたことから、RAに対してaaRSsを標的とした画期的な新規治療法の確立が期待されます。
この研究成果は、2023年7月2日(米国東部時間)のAnnals of the Rheumatic Diseases誌(オンライン版)に掲載されました。
・アフィニティービーズ技術によりブシラミンの標的タンパク質として、アミノアシルtRNA合成酵素(aaRSs)を発見しました。
・マクロファージを20種類のaaRSsで刺激すると、全てがIL-6やTNF-αなどの炎症性サイトカイン産生を誘導することを見出しました。
・実際に、RA患者においては血清中や滑膜液中にaaRSsが放出され、アラーミンとして作用することを見出しました。
・HMGB1等の他のアラーミンと比べ、aaRScは、はるかに高いサイトカイン産生を誘導することを見出しました。
・また、抗シトルリル化タンパク質抗体(ACPAs)はRAに特異性の高い抗体で、RAの診断指標や発症予測に使われている自己抗体の一つです。Protein Arginine Deiminase 4 (PAD4)はACPAsの産生誘導に中心的な役割を担っている酵素ですが、興味深いことに、aaRSsはPAD4の放出も誘導することを見出しました。
・以上から、aaRSsはサイトカイン産生を誘導し免疫応答を強烈に惹起するだけでなく、PAD4の放出を介してACPAsの産生を誘導することにより、RAにおいて2つの側面から発症や病態の悪化に関与することがわかりました。
・ブシラミンは、aaRSsを標的として結合し、炎症性サイトカインの分泌およびPAD4の放出のいずれも抑制することで、抗リウマチ作用を示すことが示されました。
RAは免疫応答の異常により関節に炎症が起こる自己免疫疾患で、日本では人口の0.5~1%が罹患し、男女比は1:3~4で女性の患者が多い疾患として知られています。RAの発症メカニズムに関しては不明な点も多く残されていますが、遺伝的要因と環境要因が組み合わさって起こる自己免疫疾患と考えられています。
サイトカインは免疫応答の制御において重要な役割を果たしています。これまでに多くの種類のサイトカインが発見され、このサイトカインの異常産生が自己免疫疾患の発症や病態悪化に大きく関与していることが明らかにされてきました。IL-6やTNF-αなどの炎症性サイトカインはRAに大きく関与しており、実際にこれらサイトカインを標的とした治療薬も開発されています。従って、RAの治療においてサイトカインの異常産生を如何に制御できるかが非常に重要であるといえます。
ブシラミンは抗リウマチ薬として知られており、サイトカイン産生を抑制することなどが知られていますが、その作用メカニズムはほとんど解明されていませんでした。研究グループは、ブシラミンの標的タンパクとしてaaRSsの同定に成功しましたが、RAにおいてaaRSsがどのように関与しているかは不明であったことから、RAとaaRSsの関連性を解明すべく研究を進めました。
これまでの報告において、tyrosyl-tRNA synthetase (YRS)をはじめとした一部のaaRSsが細胞外に放出され、さまざまな生理活性を有していることが報告されていました。研究グループはまず、細胞外aaRSsがRAの発症や症状の悪化に大きく関与しており、ブシラミンはその細胞外aaRSsの機能を阻害しているのではないかと考えました。マクロファージにおいてaaRSs刺激後、IL-6などのサイトカイン産生を調べたところ、非常に興味深いことに20種類全てのaaRSsがサイトカイン産生を誘導できることが判明しました。また、aaRSsによるサイトカイン産生にはLPSの受容体として知られているTLR4を介していることや、ブシラミンがaaRSsによるサイトカイン産生を抑制することも明らかにしました。aaRSsはアラーミンとして作用していることが示されたことから、aaRSsとこれまで知られている他のアラーミン(HMGB1など)によるサイトカイン産生量を比較したところ、それぞれ同じ濃度でマクロファージを刺激した場合、aaRSsは他のアラーミンに比べ20~100倍量近いサイトカインを誘導できることが明らかになりました。
aaRSsにアラーミン活性があることが確認されたことから、実際にRAにおいてaaRSsが細胞外に放出され、血中や病変部位に存在しているのかについて解析を進めました。健常人とRA患者血清中のaaRSs濃度を比較したところ、YRSをはじめとした一部のaaRSsの濃度がRA患者血清において有意に高くなっていることが判明しました。また、病変局所である関節の滑膜液中においては、変形性関節症の患者よりもRA患者の方が、aaRSs濃度が劇的に高いことも示されました。これらの結果から、RA患者では病変局所および全身においてaaRSsが細胞外に放出されていることが判明しました。
抗シトルリン化タンパク抗体 (Anti-citrullinated protein antibodies; ACPAs)は関節リウマチに特異性の高い抗体で、関節リウマチの診断の指標や発症予測に使われている自己抗体の一つです。PAD4はこのACPAsの産生誘導において中心的な役割を担っている酵素の一つとして知られています。非常に興味深いことに、aaRSsはマクロファージからサイトカインだけでなく、PAD4放出も誘導することが明らかになりました。実際に、PAD活性の高い患者やACPAs陽性患者において、RA患者滑膜液中のaaRSs濃度がコントロール群に比べ有意に高くなっていました。これらの結果から、aaRSsはサイトカイン産生を誘導し免疫応答を強烈に惹起するだけでなく、PAD4の放出にも関与することで、ACPAsの産生誘導にも関与していることが示され、関節リウマチにおいて2つの側面から発症や病態の進行に関与している可能性が示唆されました。
ここで重要となるのが、aaRSsをターゲットとしたRAに対する治療法の確立です。ブシラミンはaaRSsによるサイトカイン産生を抑制しましたが、低濃度のLPS刺激によるサイトカイン産生も抑制しました。このことから、ブシラミンがaaRSs特異的な阻害剤としては使用しにくいのが現状です。本来であれば、アラーミンとして機能するaaRSsを特異的にブロックするaaRSs中和抗体を作製するのが常道ですが、20種類すべてのaaRSs(あるいはそれぞれのRA患者血清において高い値を示しているaaRSs)に対する中和抗体を作製するのは現実的ではありませんでした。そこで研究グループは、阻害ペプチドの作成を試みました。ヒトYRSタンパクを53分割し、分割されたそれぞれのペプチドの中でaaRSsによるサイトカイン誘導を阻害できるペプチドがあるか探索しました。その結果、いくつかの阻害ペプチドが発見され、特にYP51と呼ばれるペプチドはRAのマウスモデルであるcollagen-induced arthritisやcollagen antibody-induced arthritisに対して高い治療効果が認められました。また、このYP51を投与されたRAマウスモデルでは血中のサイトカインやaaRSs、PAD4の濃度がコントロール群に比べ劇的に減少していることも示されました。現在のところメカニズムは不明ですが、YP51はYRSだけでなく、他のいくつかのaaRSsによるサイトカイン誘導も抑制できることが判明しています。
本研究によって、aaRSsはアラーミンとして機能しサイトカインを誘導する一方で、PAD4の放出にも関与することで、RAの発症や病態悪化に関わっていることが明らかになり、aaRSsがRAの新しい治療標的になり得ることが示されました(図1参照)。
これまでに、RAをはじめ筋炎などの自己免疫疾患においていくつかのaaRSsに対する自己抗体が産生されていることは報告されていました。ところが、aaRSsそのものが自己免疫疾患に関与しているかどうかについては殆ど解明されていませんでした。今回、研究グループはaaRSsがRA患者において病変局所や血中に高濃度で放出されていることを発見しました。細胞外aaRSsがアラーミンとして作用し、炎症性サイトカインやPAD4を放出させることでRAの病態悪化に関与していることを明らかにしました。これらの発見は、RAにおいて初めて細胞外aaRSsの作用機構を明らかにしたもので、非常に意義深い研究成果であると考えられます。
今後は、RAだけでなく他の自己免疫疾患における細胞外aaRSsのはたらきも解明していくことで、さまざまな自己免疫疾患に対してaaRSsをターゲットとした新規治療法の開発が期待されます。
【用語解説】
(注1)アミノアシルtRNA合成酵素
タンパク合成の過程において重要な酵素で、特定のアミノ酸をtRNAに結合させることでアミノアシルtRNAを合成する。原核生物から真核生物まですべての生物において保存されており、タンパク質を構成する20種類のアミノ酸それぞれに対応する20種類のアミノアシルtRNA合成酵素が存在する。
(注2)アラーミン
組織障害や細胞死によって細胞外に放出され炎症を誘導する分子の総称である。
HMGB1 (high mobility group box 1)やHSP (heat shock protein)をはじめとし、IL-1やIL-33といったサイトカインもアラーミンとして知られている。
(注3)サイトカイン
免疫細胞をはじめとしたさまざまな細胞から分泌される低分子タンパク質で、細胞間情報伝達分子としてはたらく。IL-6やTNF-aは炎症を惹起する炎症性サイトカインとして知られており、免疫細胞の活性化や分化において重要な役割を担っている。
(注4)Protein Arginine Deiminase 4 (PAD4)
タンパク質内のアルギニン残基をシトルリン残基に変換する酵素で、全部で5種類のPADが存在する(PAD1, 2, 3, 4, 6)。中でもPAD4はRAの発症や病態悪化に深く関与している。本来、PAD4は核内に存在しており、ヒストンのシトルリン化に関与しているが、PAD4が細胞外に放出されると細胞外のタンパク質をシトルリン化させることで関節リウマチの発症や増悪化に関与する。
掲載誌名:Annals of the Rheumatic Diseases
DOI:10.1136/ard-2023-224055
【論文タイトル】
Extracellular aaRSs drive autoimmune and inflammatory responses in rheumatoid arthritis via the release of cytokines and PAD4
【著者】
Akihiro Kimura, Takumi Ito, Satoshi Sakamoto, Takeshi Takagi, Iwao Seki, Masahiro Okamoto, Hiroyuki Aono, Satoshi Serada, Tetsuji Naka, Hiroaki Imataka, Kensuke Miyake, Yoshiaki Fujii-Kuriyama, Takuya Ueda, Keisuke Wakasugi, Noriko Iwamoto, Norio Ohmagari, Hiroyuki Yamashita, Hiroshi Kaneko, Haruka Tsuchiya, Keishi Fujio, Hiroshi Handa*, Harumi Suzuki* *:責任著者
科学研究費 基盤 研究(S)
国際連携研究費 from BMS/Celgene
本件に関するお問い合わせ先
企画部 広報・社会連携推進室
- 住所
- 〒160-8402 東京都新宿区新宿6-1-1
- TEL
- 03-3351-6141
- d-koho@tokyo-med.ac.jp