東京医科大学が「薬の種類や多剤併用が及ぼすヒト腸内細菌への全貌を解明 ~ 世界に類を見ない腸内細菌叢ビッグデータベースを構築 ~ 」
●日本人約4,200例を対象に、糞便のショットガンメタゲノムシークエンス 1) を行い、膨大な生活習慣や臨床情報と腸内微生物叢情報を統合した世界初の大規模マイクロバイオームデータベースを構築しました。
●腸内細菌叢に影響を与える外的・内的要因を網羅的に調査し、薬剤投与が食事、生活習慣、疾患よりも腸内細菌叢に与える影響が強いことを発見しました。
●腸内細菌叢に影響を与える薬剤の種類を詳細に調べ、影響の強さでランキング化したところ、消化器疾患薬や糖尿病薬の影響度が高いことを発見しました。
●薬剤の多剤併用(ポリファーマシー)による腸内細菌種の変化、細菌の遺伝子機能プロファイルの変化、薬剤耐性遺伝子プロファイルの変化を同定しました。
●個々の薬剤や多剤併用による腸内細菌叢の変化は、薬剤の使用中断や投与数の減少により元の状態にまで戻すことができることを見出しました。
今回の研究結果は、様々な種類の薬剤と腸内細菌叢の関連を網羅したカタログ(辞書)を提供したことになり、医師や患者が薬剤選択をする上で有用な知見となりえます。また、薬剤により変動した特定の腸内細菌が長期薬剤使用や多剤併用により生じる副作用を予測するバイオマーカーになりえます。さらに、特定の腸内細菌をターゲットとした薬剤関連疾患の発症予防や治療法の開発につながることが期待されます。
【研究の背景】
人口の高齢化に伴い薬剤を内服する患者数は増加しており、特定の薬剤だけでなく多剤併用に伴う副作用や薬剤に関連する新たな疾患発症が世界的な問題となっています。一方、ヒトの腸管には千種類以上の常在菌が生息しており、それらの集合は「マイクロバイオーム」と呼称され、ヒトの健康長寿や病気の発症を理解する上での重要な要素となっています。今回、日本人を対象に、最新の解析技術を用いて腸内の微生物とそれらが持つ遺伝子情報を網羅的に同定しました。さらに、詳細な臨床データと組み合わせたビッグデータ解析を行うことで、マイクロバイオームと薬剤の使用との関連を詳細に検証しました。
【本研究で得られた結果・知見】
1.世界に類を見ない情報量と多数例の腸内マイクロバイオームデータベースを構築
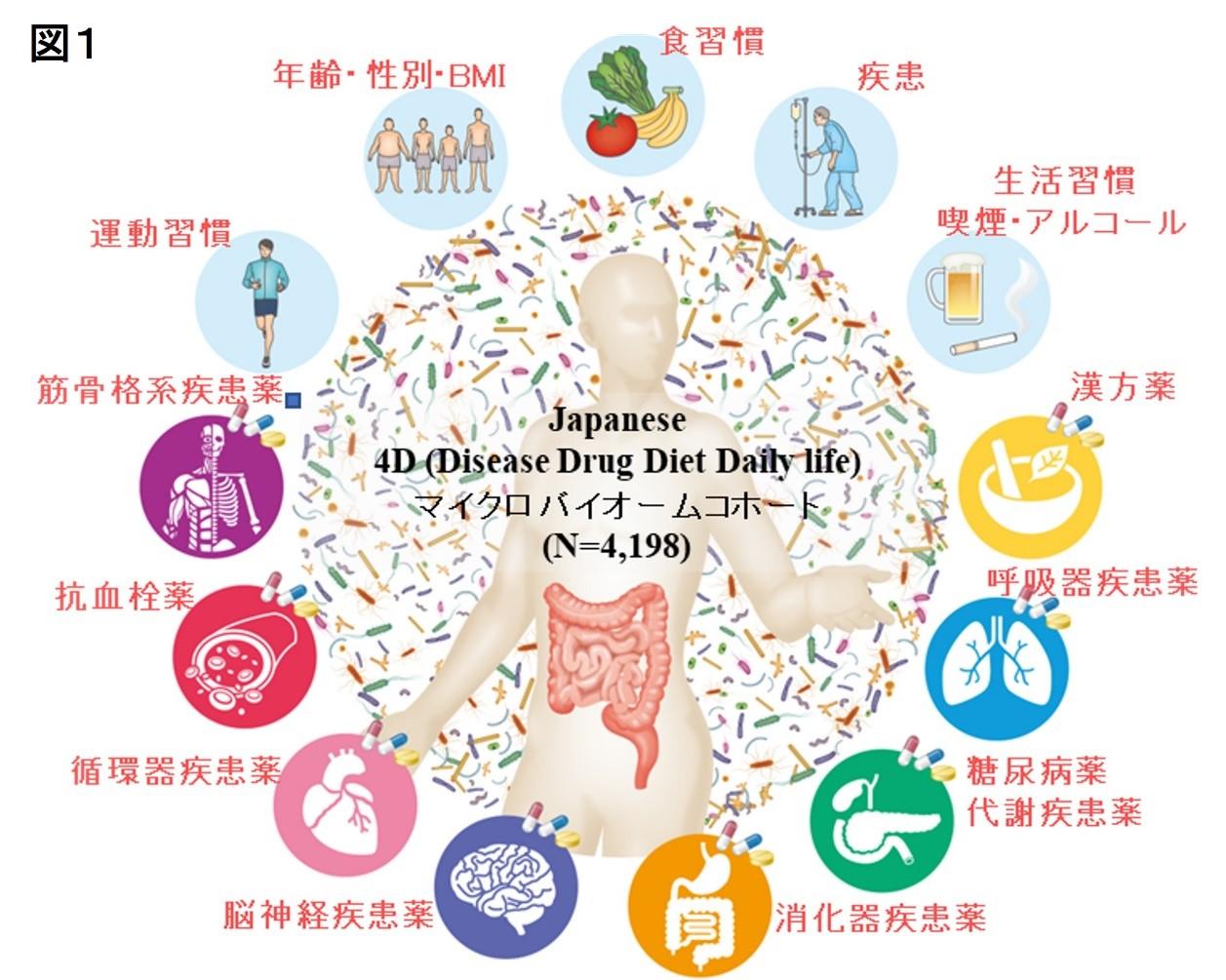
日本人約4,200例を対象に、詳細なメタデータとマイクロバイオームデータを統合した大規模データベースを構築し、Japanese 4D(Disease Drug Diet Daily life)コホートと命名しました(図1)。メタデータには、多彩な疾患や薬剤情報、食習慣、生活習慣、身体測定因子、運動習慣などが含まれ、特に薬剤に関しては750種類以上の薬剤投与歴を網羅的に収集しました。さらに、4,200例の糞便をショットガンメタゲノムシークエンスで解析し、腸内細菌1,773種(種レベル)、 腸内細菌の遺伝子機能10,689個、薬剤耐性遺伝子403個を同定しました。また、日本人の腸内にはBacteroides、Bifidobacterium、Clostridiales、Blautia、Faecalibacteriumなどの菌種(属レベル)が多いことを大規模データから明らかにしました。このような膨大な生活習慣・臨床情報とマイクロバイオーム情報を統合したデータは世界の中でも最も大規模なものの一つです。
2. 日本人の腸内細菌叢に影響を与える要因をランキング
様々な外的・内的要因が腸内細菌叢のバランスに影響を及ぼすことが分かっていますが、それら要因を網羅的に解析した研究は少ないのが現状でした。日本人の腸内細菌叢を対象にした本研究により、薬剤の影響が最も強く、次いで疾患、身体測定因子(年齢・性別・BMI)、食習慣、生活習慣、運動習慣の順であることが明らかになりました(図2A)。薬剤が及ぼす影響は食習慣、生活習慣、運動より3倍以上も強く、この影響度の強さは、腸内細菌叢を属、種、遺伝子機能等の様々なレベルで解析しても同様な結果でした(図2A)。この結果は、ヒトマイクロバイオーム研究における、「薬剤情報の収集の重要性」と「薬剤投与歴を考慮した解析の必要性」を強調する結果といえます。
3.腸内細菌叢に影響を与える薬剤の種類をランキング
次に、薬剤の中でどのような疾患治療薬が腸内細菌叢に強い影響を及ぼすのかを検証しました。様々なメタデータを交絡因子として組み入れた多変量解析を行ったところ、消化器疾患治療薬、糖尿病薬、抗生物質、抗血栓薬、循環器疾患薬、脳神経疾患薬、抗がん剤、筋骨格系疾患薬、泌尿器・生殖器疾患薬、その他(呼吸器系疾患薬や漢方薬)の順で影響が強いことが分かりました(図2B)。また、消化器系疾患薬の中では、Proton-pump inhibitor (PPI)、potassium-competitive acid blocker(P-CAB)などの胃酸分抑制薬、Osmotic acting laxative(浸透圧性下剤)、アミノ酸製剤、胆汁酸促進剤の影響が強く、糖尿病薬の中ではαグルコシダーゼ阻害薬が最も強く影響することが判明しました(詳細は論文中に記載)。さらに、特定の疾患と疾患治療薬の腸内細菌の変動は異なることも分かりました(論文中に記載)。これまでの研究では、薬剤の種類が50以下と少ないことが問題でしたが、我々は759種類もの薬剤を研究に含めました。これにより、疾患治療薬という大分類で腸内細菌叢への影響を概観しつつ、個々の治療薬の影響までも詳細に明らかにすることができました。
4.薬剤の多剤併用(ポリファーマシー)が及ぼす腸内細菌叢の変化を同定
次に、個々の患者における薬剤投与の「数」に注目し、薬剤投与数の増加に伴う腸内細菌叢の変化を検証しました。4,200例の中で、10剤以上の薬剤を服用している患者は603例(14%)でした(図3A)。まず、薬剤投与数が増えるにつれて腸内に常在している日和見感染症を引き起こす病原菌が増えることを発見しました(図3B)。特に、Enterococcus faecium、Enterococcus faecalis、Klebsiella Oxytoca、Klebsiella pnuemoniae、 Acinetobacter baumannii、Streptococcus pneumoniaeなどの菌種が薬剤投与数とともに腸内で増加すること(正の相関)を見出しました。
次に、日本人4,200例の腸内細菌が有する薬剤耐性遺伝子 3) (抗生剤耐性遺伝子)を網羅的に調べ、403個の腸内薬剤耐性遺伝子(Gut resistome)を同定しました。薬剤投与数と腸内細菌叢がコードする耐性遺伝子の量との関連を検証したところ、投与数が増加するにつれて耐性遺伝子の量も増加することが判明しました(図3C)。一般的に、薬剤投与数は疾患数が増えるにつれて増加するため、両者の違いに注目しました。疾患数と薬剤投与数の間で共通して関連する腸内細菌(Streptococcus属やLactobacillous属など)がいくつか明らかとなりましたが、両者の間で異なる腸内細菌も多数存在することが判明しました(図3D)。特に、薬剤投与数の増加は多様な菌種の減少と関連しており、その多く(Blautia、Facaebacterium、Lachnospiraceae、Eubacterium、Clostridium、Dorea)は酪酸や酢酸など短鎖脂肪酸 2) を産生する菌でした。腸内細菌により生成される短鎖脂肪酸には免疫の恒常性を保つ働きがあることが分かっており、これら菌種が減少することは宿主の免疫恒常性にも影響があることが予想されます。今回、多剤併用による日和見感染症の病原菌の増加や、薬剤耐性遺伝子の増加、免疫恒常性と関連する菌が減少した知見は、多剤併用が腸内環境へ悪影響を与えることで、好ましくない転帰を引き起こす可能性を示唆しています。
次に、横断研究(N=4,200)で得られた「薬剤や腸内細菌叢との関連」に関して、薬剤が原因で腸内細菌叢が変化したのか(原因)、または薬剤を摂取するような人は元々変化した腸内細菌叢を持っていたのか(結果)を検証しました。同一患者でPPI投与前後において2回糞便を収集し(N=243)、ショットガンシークエンスを行いました。1回目と2回目の糞便サンプルを比較することで、PPIの使用を開始した後、Lactobacillus属やStreptococcus属の腸内細菌の増加やE,faeciumやS,pnuemoniaeなどの日和見感染症を引き起こす病原菌種が増加することが分かりました(図4A)。一方、PPIの使用を中断すると、これら菌種は減少することが判明しました(図4A)。これらの結果は、横断研究で明らかとなった結果と一致しており、実際に薬剤が原因となって腸内細菌叢が変化したこと、さらにはPPIの使用により変化した腸内細菌叢は、PPIの使用を中断することで元に戻せる可能性が示唆されました。そして、薬剤投与数が増加した被験者ではStreptococcus属やLactobacillus属などの腸内細菌の増加を示し(図4B)、Cationic antimicrobial peptide resistanceなど特定の代謝経路に関わる遺伝子が増加することが明らかとなりました(図4C)。一方、薬剤投与数を減少することでこれらの菌種や遺伝子機能は減少することが判明しました(図4BC)。
以上の結果から、薬剤の使用が実際に腸内細菌叢の変化を引き起こすこと、さらに、不適切または過剰な薬剤投与により変化した腸内細菌叢は、薬剤の使用を中止することでその影響を減らすことができることが強く示唆されました。
【今後の研究展開および波及効果】
世界に類を見ない情報量と多数例の解析から、薬剤が及ぼす腸内マイクロバイオームへの広範囲な影響を見出しました。この影響は可逆的な一面もあり、不必要な薬剤の投与を見直す必要性が強調されました。そして、今回の研究結果は、どの薬剤がどの程度腸内細菌叢に影響するのかを検索できるカタログ(辞書)を提供したことになり、医師や患者が薬剤選択をする上で有用な知見となりえます。また、薬剤により増加もしくは減少した特定の腸内細菌が、長期薬剤使用や多剤併用により生じる副作用を予測するバイオマーカーになる可能性があります。さらに、特定の腸内細菌をターゲットとした薬剤関連疾患の発症予防や治療法の開発につながることが期待されます。
【掲載誌名・DOI】
掲載誌名:Gastroenterology
DOI: 10.1053/j.gastro.2022.06.070
掲載誌 URL:
https://www.gastrojournal.org/article/S0016-5085(22)00732-6/fulltext
【論文タイトル】
Population-level metagenomics uncovers distinct effects of multiple medications on the human gut microbiome
【著者】
Naoyoshi Nagata*, Suguru Nishijima*, Miyoshi-Akiyama Tohru, Yasushi Kojima, Moto Kimura, Ryo Aoki, Mitsuru Ohsugi, Kohjiro Ueki, Kuniko Miki, Eri Iwata, Kayo Hayakawa, Norio Ohmagari, Shinichi Oka, Masashi Mizokami, Takao Itoi, Takashi Kawai, Naomi Uemura, Masahira Hattori.
永田 尚義*, 西嶋 傑*, 秋山 徹, 小島 康志, 木村 基, 青木 亮, 大杉 満, 植木 浩二郎, 三木 邦寿, 岩田 英里, 早川 佳代, 大曲 貴夫, 岡 慎一, 溝上 雅史, 糸井 隆夫, 河合 隆, 上村 直実, 服部 正平(*責任著者)
【主な競争的研究資金】
本研究は、日本学術振興会科学研究費助成事業 基盤研C JP17K09365(代表:永田尚義)、COCKPI-T Funding(代表:永田尚義)、武田科学振興財団研究助成(代表:永田尚義)、喫煙財団研究助成(代表:永田尚義)、ダノン学術研究助成(代表:永田尚義)、J-milk学術研究助成(代表:永田尚義)、上原記念生命科学財団研究助成(代表:永田尚義)、東京医大学長裁量経費(代表:永田尚義)、基盤研C JP 20K08366(代表:河合隆)、国際医療研究開発費19A1011(代表:小島康志)、国際医療研究開発費28-2401(代表:永田尚義、上村直実)の支援を受け実施しました。
【補足資料:図解・表等 添付】
1) ショットガンメタゲノムシークエンス
サンプル中の微生物を単離や培養することなく、DNA集合体を網羅した状態でゲノム配列を解読することである。16S rRNAシークエンスとは異なり、全ゲノム配列を対象とするため、より精度の高い菌種組成の解明が可能である。また、16S rRNA解析では困難であった、菌叢の持つ機能・代謝遺伝子、細菌だけでなく、古細菌、バクテリオファージ、真菌なども解析可能である。
腸内細菌が産生する酪酸、プロピオン酸、酢酸などの有機酸のこと。ヒトの免疫の恒常性を保つ作用(抗炎症作用)を持つほか、腸上皮細胞のエネルギー源となり、さらに腸管粘膜で抗微生物効果を示すなど、ヒトにおいて優れた生理効果を発揮することが分かっている。がん患者や炎症性腸疾患患者ではこの短鎖脂肪酸産生と関与する菌群が共通して減少している。
臨床現場では、不適切な投与量、不適切な薬剤の選択、あるいは不適切な廃棄の結果として細菌が抗生物質に暴露されやすい。細菌が抗生物質による選択的な圧力に曝されることで、時間とともに薬剤質耐性遺伝子(Antibiotic Resistance Genes:ARGs)を獲得することがある。これら薬剤耐性遺伝子を獲得した菌(耐性菌)が世界中で増加している現状から、耐性菌抑制は世界的な課題となっている。
本件に関するお問い合わせ先
企画部 広報・社会連携推進室
- 住所
- 〒160-8402 東京都新宿区新宿6-1-1
- TEL
- 03-3351-6141
- d-koho@tokyo-med.ac.jp