【京都産業大学】院内感染を起こすことで注意が喚起されているディフィシル菌の二成分毒素の複合体構造を解明!英国科学誌『Nature Communications』(オンライン版)に掲載
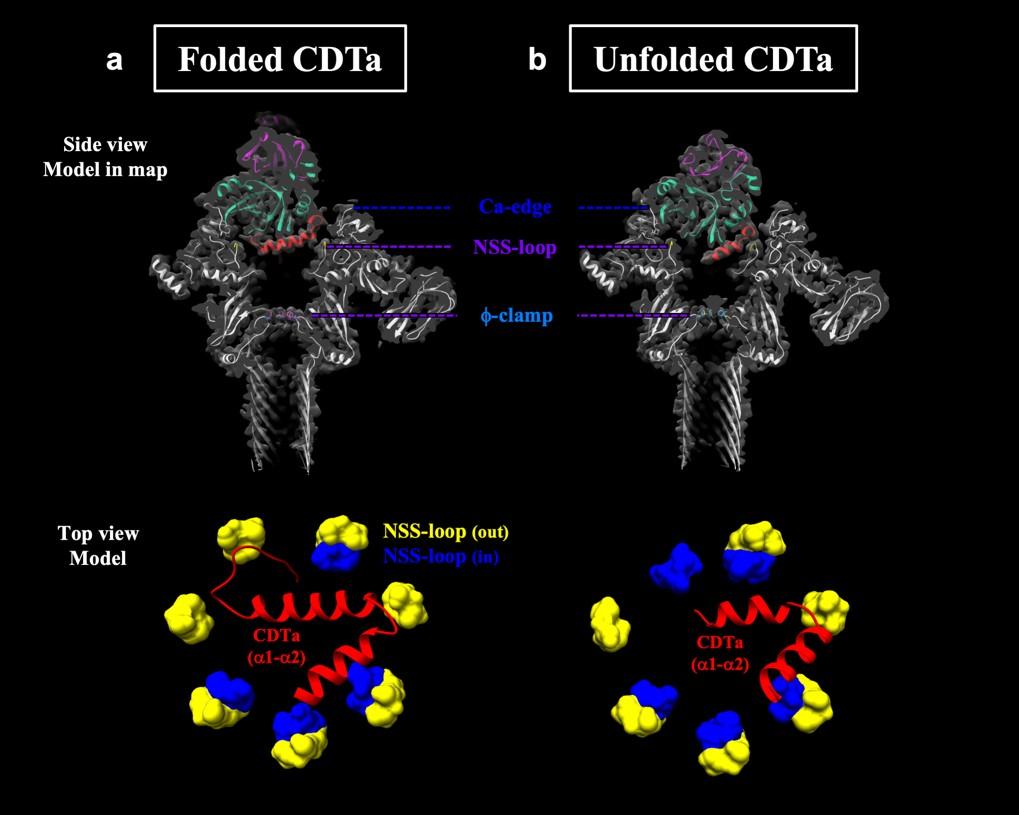
本研究では、CDTaとCDTb膜孔の複合体の構造解析によって、解明されていないCDTaの膜透過機構について注目。クライオ電子顕微鏡を用いた解析から、3D variability analysis (3DVA) によるクラス分けを行った結果、「CDTaが膜孔CDTbに結合し、N末端先端から解ける」という、タンパク質透過機構の最初の動的な様子を明らかにした。
津下教授は、「CDTaが結合した、CDTb膜孔ヘプタマーの構造は、Iaが結合した、Ib膜孔ヘプタマーの構造とほぼ同じでした。この特徴は、その結合により、A成分のN末端αヘリックスがアンフォールドして、残りのαヘリックスが傾く。このことによりアンフォールド鎖はB成分の膜孔の最狭窄部位であるφクランプに向かっています。我々の研究から、二成分毒素で共通したアンフォールドの機構がわかってきました。特に、今回のCDTb膜孔の解析で特筆すべきは、CDTaが結合してから、その先端がアンフォールドするまでの動的な様子が、詳細にわかってきたことです(図1)。これは膜透過機構の理解の上で重要なマイルストーンとなる知見です」とコメントしている。
この研究成果は、2022年10月17日(日本時間)に英国科学雑誌『Nature Communications』(オンライン版)に掲載された。
むすんで、うみだす。 上賀茂・神山 京都産業大学
■関連リンク
・ディフィシル菌の二成分毒素の複合体構造を解明
https://www.kyoto-su.ac.jp/news/2022_ls/20221021_400a_ronbun.html
・CDTb膜孔中でのCDTaが結合した直後の状態(フォールド)とN末端が解けた状態(アンフォールド)
https://static-content.springer.com/esm/art%3A10.1038%2Fs41467-022-33888-4/MediaObjects/41467_2022_33888_MOESM3_ESM.mp4
・京都産業大学 生命科学部 先端生命科学科 津下英明 教授
https://www.kyoto-su.ac.jp/faculty/professors/ls/tsuge-hideaki.html
・タンパク質動態研究所
https://www.kyoto-su.ac.jp/research/ph/kikou_pr.html
本件に関するお問い合わせ先
京都産業大学 広報部
- 住所
- 〒603-8555 京都市北区上賀茂本山
- TEL
- 075-705-1411
- FAX
- 075-705-1987
- kouhou-bu@star.kyoto-su.ac.jp