【東京医科大学】DNA障害に呼応したp53活性化は、リソソーム膜の損傷と細胞保護的オートファジーの2つを同時に誘導する ~ p53による新たな細胞死制御機構の発見とリソソームを標的とする新規がん治療法への応用展開 ~
東京医科大学(学長:林 由起子/東京都新宿区)生化学分野 宮澤啓介主任教授、高野直治准教授と耳鼻咽喉科・頭頸部外科学分野 塚原清彰主任教授、山下凱後期臨床研修医を中心とする研究グループは、DNA障害性抗がん剤処理によりがん細胞において、p53依存的に細胞傷害性のあるリソソーム膜透過性の亢進(1)と細胞保護的なオートファジーが同時に誘導されることを発見しました。本研究は2022年12月29日に「Cell Death Discovery」誌にオンライン掲載されました。
【概要】
東京医科大学(学長:林 由起子/東京都新宿区)生化学分野 宮澤啓介主任教授、高野直治准教授と耳鼻咽喉科・頭頸部外科学分野 塚原清彰主任教授、山下凱後期臨床研修医を中心とする研究グループは、DNA障害性抗がん剤処理によりがん細胞において、p53依存的に細胞傷害性のあるリソソーム膜透過性の亢進(1)と細胞保護的なオートファジーが同時に誘導されることを発見しました。
この発見は、野生型p53を発現するがん細胞に、DNA障害性抗がん剤とオートファジー阻害剤を同時に投与した際には、リソソーム内のカテプシン等の加水分解酵素の細胞質への放出により殺細胞効果が著しく増強するメカニズムを示すものです。本研究は2022年12月29日に「Cell Death Discovery」誌にオンライン掲載されました。
東京医科大学(学長:林 由起子/東京都新宿区)生化学分野 宮澤啓介主任教授、高野直治准教授と耳鼻咽喉科・頭頸部外科学分野 塚原清彰主任教授、山下凱後期臨床研修医を中心とする研究グループは、DNA障害性抗がん剤処理によりがん細胞において、p53依存的に細胞傷害性のあるリソソーム膜透過性の亢進(1)と細胞保護的なオートファジーが同時に誘導されることを発見しました。
この発見は、野生型p53を発現するがん細胞に、DNA障害性抗がん剤とオートファジー阻害剤を同時に投与した際には、リソソーム内のカテプシン等の加水分解酵素の細胞質への放出により殺細胞効果が著しく増強するメカニズムを示すものです。本研究は2022年12月29日に「Cell Death Discovery」誌にオンライン掲載されました。
【本研究のポイント】
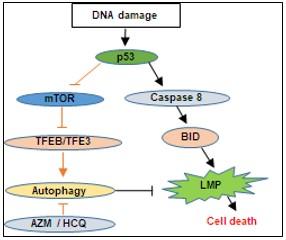
・DNA障害性抗がん剤処理を行ったがん細胞では、p53の下流で、Caspase-8 → BID経路を介したリソソーム膜透過性の亢進が引き起こされ、リソソーム内の加水分解酵素の細胞質への放出により細胞死が誘導される。
・これと並行してDNA障害性抗がん剤処理を行ったがん細胞では、p53の下流で、mTOR→ TFEB/TFE3経路を介した細胞保護的なオートファジー誘導が活性化され、膜障害を受けたリソソームの除去(リソファジー, lysophagy(2))に働くと考えられる。
・これにより、DNA障害性抗がん剤とオートファジー阻害薬の併用は、p53野生型がん細胞において、殺細胞効果を増強する。
・DNA障害性抗がん剤処理を行ったがん細胞では、p53の下流で、Caspase-8 → BID経路を介したリソソーム膜透過性の亢進が引き起こされ、リソソーム内の加水分解酵素の細胞質への放出により細胞死が誘導される。
・これと並行してDNA障害性抗がん剤処理を行ったがん細胞では、p53の下流で、mTOR→ TFEB/TFE3経路を介した細胞保護的なオートファジー誘導が活性化され、膜障害を受けたリソソームの除去(リソファジー, lysophagy(2))に働くと考えられる。
・これにより、DNA障害性抗がん剤とオートファジー阻害薬の併用は、p53野生型がん細胞において、殺細胞効果を増強する。
【研究の背景】
私達の研究グループでは、これまでDNA障害性抗がん剤とオートファジー阻害効果を持つマクロライド系抗生物質のアジスロマイシンの併用により、p53野生型のがん細胞への殺細胞効果が増強されること、また、その増強効果が、ダメージを受けた異常なリソソームの細胞質内への過度な蓄積によるものであることを発表しました(Toriyama et. al., 2021, Cancer Sci)。しかしながら、なぜp53依存的にその増強効果が発揮されるのか、不明な点も残っていました。そこで将来的にDNA障害性抗がん剤とオートファジー阻害効果を持つアジスロマイシンの併用療法によるリソソームを標的としたがんの新規治療法を目指すため、その作用機序の解明を目指しました。
私達の研究グループでは、これまでDNA障害性抗がん剤とオートファジー阻害効果を持つマクロライド系抗生物質のアジスロマイシンの併用により、p53野生型のがん細胞への殺細胞効果が増強されること、また、その増強効果が、ダメージを受けた異常なリソソームの細胞質内への過度な蓄積によるものであることを発表しました(Toriyama et. al., 2021, Cancer Sci)。しかしながら、なぜp53依存的にその増強効果が発揮されるのか、不明な点も残っていました。そこで将来的にDNA障害性抗がん剤とオートファジー阻害効果を持つアジスロマイシンの併用療法によるリソソームを標的としたがんの新規治療法を目指すため、その作用機序の解明を目指しました。
【本研究で得られた結果・知見】
図1.DNA障害性抗がん剤(DOX)処理によって、p53、BID依存的にリソソーム膜の障害が引き起こされる。
p53ノックアウト細胞(A)や、p53により転写制御を受けているBIDのノックダウン細胞(B)では、DOX処理により誘導されるリソソーム膜障害が強く抑制されました。(リソソーム膜の障害は、リソソームから細胞質へと漏出した酵素活性を測定することで定量)
図1.DNA障害性抗がん剤(DOX)処理によって、p53、BID依存的にリソソーム膜の障害が引き起こされる。
p53ノックアウト細胞(A)や、p53により転写制御を受けているBIDのノックダウン細胞(B)では、DOX処理により誘導されるリソソーム膜障害が強く抑制されました。(リソソーム膜の障害は、リソソームから細胞質へと漏出した酵素活性を測定することで定量)
図2.DNA障害性抗がん剤のドキソルビシン(DOX)とオートファジー阻害活性を持つアジスロマイシン(AZM)の併用により、細胞死がp53依存的に増強される。
縦軸は死細胞数、横軸は薬剤処理後の時間を示します。p53野生(正常)型がん細胞(左)では、DOXとAZMの併用により、リソソーム膜の透過性亢進による細胞死の増強が観察されました。一方、p53 ノックアウト細胞(右)では、併用による細胞死の増強が認められませんでした。
縦軸は死細胞数、横軸は薬剤処理後の時間を示します。p53野生(正常)型がん細胞(左)では、DOXとAZMの併用により、リソソーム膜の透過性亢進による細胞死の増強が観察されました。一方、p53 ノックアウト細胞(右)では、併用による細胞死の増強が認められませんでした。
【今後の研究展開および波及効果】
チロシンキナーゼ阻害剤やプロテアソーム阻害剤などの様々な分子標的薬の投与により、がん細胞内ではオートファジーが誘導されることが知られています。オートファジーは、がん細胞にとって「細胞保護的」に機能することから、種々の抗がん剤とオートファジー阻害剤との併用療法が期待されます。一方、リソソーム内には約60種類もの加水分化酵素が含まれ、リソソーム膜がこれを包み込んで隔離することで、細胞の「自爆」を防いでいます。また、膜ダメージを受けたリソソームはオートファジーで迅速に分解除去されます。
本研究によりp53野生型がん細胞では、DNA障害性薬剤によりリソソームの膜透過性の亢進とオートファジーが同時に誘導される分子制御機構が明らかにされました。これにより、がん治療におけるオートファジー阻害剤の適応症例の抽出や、リソソーム自体を治療標的とする新たな治療法の開発への可能性が示されました。
今後は、野生型p53を持つ正常細胞への効果との違いなどを明らかにすることで、DNA障害性抗がん剤とアジスロマイシンの併用をがん治療に用いた際、副作用の増強に繋がらないかなどを調べることが、臨床応用を目指す上で重要な課題であると考えます。
チロシンキナーゼ阻害剤やプロテアソーム阻害剤などの様々な分子標的薬の投与により、がん細胞内ではオートファジーが誘導されることが知られています。オートファジーは、がん細胞にとって「細胞保護的」に機能することから、種々の抗がん剤とオートファジー阻害剤との併用療法が期待されます。一方、リソソーム内には約60種類もの加水分化酵素が含まれ、リソソーム膜がこれを包み込んで隔離することで、細胞の「自爆」を防いでいます。また、膜ダメージを受けたリソソームはオートファジーで迅速に分解除去されます。
本研究によりp53野生型がん細胞では、DNA障害性薬剤によりリソソームの膜透過性の亢進とオートファジーが同時に誘導される分子制御機構が明らかにされました。これにより、がん治療におけるオートファジー阻害剤の適応症例の抽出や、リソソーム自体を治療標的とする新たな治療法の開発への可能性が示されました。
今後は、野生型p53を持つ正常細胞への効果との違いなどを明らかにすることで、DNA障害性抗がん剤とアジスロマイシンの併用をがん治療に用いた際、副作用の増強に繋がらないかなどを調べることが、臨床応用を目指す上で重要な課題であると考えます。
【掲載誌名・DOI】
掲載誌名:Cell Death Discovery
DOI:10.1038/s41420-022-01293-x
【論文タイトル】
p53 regulates lysosomal membrane permeabilization as well as cytoprotective autophagy in response to DNA-damaging drugs
【著者】
Gai Yamashita, Naoharu Takano *, Hiromi Kazama, Kiyoaki Tsukahara, Keisuke Miyazawa
(*責任著者)
【主な競争的研究資金】
本研究は、日本学術振興会科学研究費 基盤研究 C(20K07298)、公益財団法人東京医科大学がん研究事業団の支援を受けています。
【補足説明】
(1) リソソーム膜透過性の亢進:リソソームは細胞内小器官の1つであり、膜で囲まれた内側は細胞質よりも酸性に保たれ、様々な分子を分解する酵素を多く含む。これにより、細胞内での様々な高分子の分解、再利用を支える小器官である。しかしながら、リソソームの膜が傷つき膜の透過性が亢進し、内容物が細胞質へ漏出すると、様々な分解酵素が分解するべきでない物を壊すため、細胞死を誘導することが知られている。
(2) リソファジー(lysophagy): ダメージを受けたリソソームが選択的にオートファジーで分解され細胞内から除去されるプロセス。
本件に関するお問い合わせ先
企画部 広報・社会連携推進室
- 住所
- 〒160-8402 東京都新宿区新宿6-1-1
- TEL
- 03-3351-6141
- d-koho@tokyo-med.ac.jp