【大阪大学】卵巣がんのプラチナ抵抗性に関与する特殊な細胞群を同定 — 卵巣がんに対する新しい治療戦略の開発に期待
◆卵巣がんの治療においては、がん細胞が標準治療薬であるカルボプラチンなどのプラチナ系抗がん剤に対し耐性を獲得してしまう現象が問題となるが、こうしたプラチナ抵抗性(※1)卵巣がんに対しては未だに良い治療方法が確立されていない。
◆病理組織を用いて卵巣がんのプラチナ抵抗性に関与する特殊な細胞群を同定。
◆耐性化メカニズムのひとつを解明し、マウスを用いた動物実験で新規治療の効果を実証。
◆治療抵抗性の予測システムや、新しい組合せの併用薬物療法の開発が期待される。
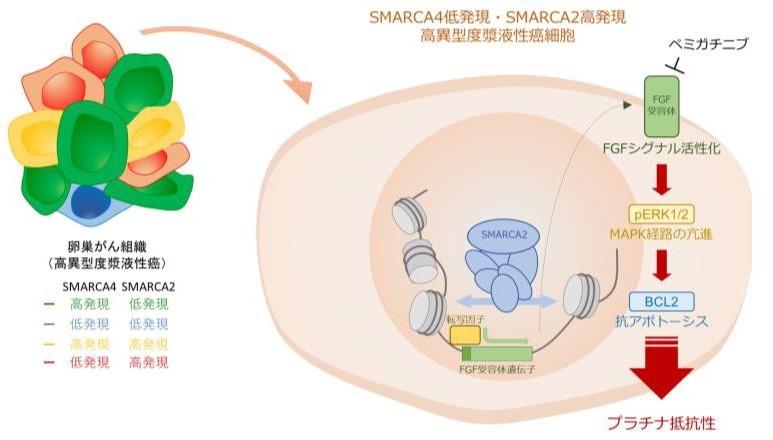
大阪大学大学院医学系研究科・病態病理学の城戸完介さん(博士課程)、野島聡准教授、森井英一教授らの研究グループは、卵巣高異型度漿液性癌(らんそうこういけいどしょうえきせいがん)の組織中に存在するSMARCA4低発現かつSMARCA2高発現の特殊な癌細胞群が、プラチナ抵抗性に寄与していることを世界で初めて明らかにしました(図1)。
卵巣がんの治療においては、がん細胞が標準治療薬であるカルボプラチンなどのプラチナ系抗がん剤に対し耐性を獲得してしまう現象が問題となりますが、こうしたプラチナ抵抗性卵巣がんに対しては未だに良い治療方法が確立されていません。
今回、研究グループは、患者さんから採取された卵巣がんの病理組織中の1個1個のがん細胞のタンパク質発現パターンを詳細に解析し、プラチナ抵抗性を示すがん組織の中で増加している特殊ながん細胞群を同定することに成功しました。さらに、がん細胞株を用いた実験やバイオインフォマティクスの解析手法を駆使することで、これらのがん細胞群では線維芽細胞増殖因子(FGF)シグナルの活性化が起こっていることを明らかにしました。マウスを用いた動物実験では、FGFシグナルを阻害するFGF受容体阻害薬(ペミガチニブ)とプラチナ系抗がん剤(カルボプラチン)との併用療法に挑戦し、これらの薬剤の組み合わせが効果的であることを証明しました。
今回発見した特殊な細胞群に着目することで、再発前に卵巣がんのプラチナ抵抗性を予測する新しい診断システムの確立や、FGFシグナルを阻害する薬剤を取り入れた新しい組み合わせの併用薬物療法の開発が期待されます。
本研究成果は、2023年2月10日(日本時間)に英国科学誌『The Journal of Pathology』(オンライン)に掲載されました。
【研究の背景】
卵巣がんは早期発見・早期治療が難しく、致死率の高い、女性特有の重要ながんです。卵巣がんにはいくつもの種類がありますが、世界的に、高異型度漿液性癌というタイプが最も多くなっています。高異型度漿液性癌の治療においては、がん細胞が標準治療薬であるカルボプラチンなどのプラチナ系抗がん剤への耐性を獲得してしまう現象がしばしば観察されますが、このような場合に有効な治療法は未だ確立されていません。
ところで、一人ひとりの患者さんに生じた1つのがん組織を構成するがん細胞は一見どれも同じものであるように思われるかもしれませんが、実はさまざまな性格を持つ多彩ながん細胞が混じり合って存在しているということが知られています。これは「腫瘍内多様性」と呼ばれ、がんが抗がん剤耐性を生じる一因であるとも考えられています。この腫瘍内多様性の形成にはゲノムそのものが変化することだけでなくゲノムを修飾するエピゲノムという因子も重要であるということが近年明らかになりつつあります。しかし、卵巣高異型度漿液性癌のプラチナ抵抗性と腫瘍内多様性、エピゲノムを司る分子との関連については未だ解明されていない点が多く残されています。
【研究の内容】
今回研究グループは、遺伝子発現をエピジェネティックに制御するSWI/SNF複合体(※2)のATPaseドメインを担うSMARCA4(BRG1)、SMARCA2(BRM)という2つの分子に着目し、これらの発現パターンによって高異型度漿液性癌の組織中に存在する癌細胞を性格づけようと試みました。
初めに、患者さんから手術によって採取された卵巣高異型度漿液性癌の病理組織標本を用いて標準的な免疫組織化学による検討を行ったところ、プラチナ抵抗性再発を来した症例群ではSMARCA4の発現が低く、SMARCA2の発現が高いという傾向があることが分かりました。
次に、チラミドシグナル増幅法という技術を用いた蛍光多重免染色システムを応用し、これらの癌組織を構成する癌細胞のSMARCA4とSMARCA2の発現パターンを同一切片上で、かつ1細胞レベルで詳細に評価したところ、プラチナ抵抗性再発群ではSMARCA4低発現かつSMARCA2高発現という発現パターンを示す癌細胞の数が多いことが分かりました(図2) 。
次に、癌細胞株を用いて分子生物学的な手法により仮説の検証を行いました。すなわち、SMARCA2発現プラスミドベクターの安定導入と低分子干渉RNA(siRNA) によるSMARCA4のノックダウンとを併用することでSMARCA4低発現かつSMARCA2高発現の性質をもつ高異型度漿液性癌細胞株を作製し、これらの細胞が最も高いカルボプラチン耐性を示すことを証明しました(図3)。
さらに、作製した細胞株を用いたRNAシークエンス(RNA-seq)とオープンクロマチン解析(ATAC-seq)、 およびパブリックデータベースの再解析といったバイオインフォマティクスの手法を駆使することで、これらの特殊な細胞群においては、線維芽細胞増殖因子(FGF)シグナル(※3)が活性化していることを明らかにしました(図4)。
細胞実験による検証を経て、今回発見された細胞群はFGFシグナルの活性化、マイトジェン活性化プロテインキナーゼ(MAPK)経路の活性化、および抗アポトーシス分子(※4)の発現上昇を通じてプラチナ抵抗性を生じているものと結論付けました(図1)。
実際、培養ディッシュ内あるいは免疫不全マウスを用いた皮下移植モデルによる治療実験では、FGFシグナルを阻害するFGF受容体阻害薬(ペミガチニブ(※5 ))とプラチナ系抗がん剤(カルボプラチン)との併用療法が、今回発見した癌細胞集団に対して効果的であることが証明されました(図5)。
【本研究成果が社会に与える影響(本研究成果の意義)】
本研究成果により、卵巣がんのプラチナ抵抗性に寄与する特殊ながん細胞群と、これらの抗がん剤耐性を規定する分子メカニズムが明らかになりました。今回発見された特殊ながん細胞を測定対象とすることで、患者さんの卵巣がんが再発する前にプラチナ系抗がん剤の効果を予測する新しい診断システムを確立することが出来るかもしれません。また、このような性質のがん細胞が増加してプラチナ抵抗性を来してしまった卵巣がんに対し、FGFシグナルを標的に取り入れた新しい組み合わせの併用薬物治療が開発されることも期待されます。
【特記事項】
本研究成果は、2023年2月10日(日本時間)に英国科学誌『The Journal of Pathology』(オンライン)に掲載されました。
著者名:城戸完介 1、野島聡* 1、元岡大祐 2,3,4、野村悠介 1、小原正治 1、佐藤和明 1、大島健司 1、田原紳一郎 1、倉重真沙子 1、梅田大介 1、高島剛志 1、清川博貴 1、 右近琴 1、松井崇浩 1、奥崎大介2,3,4、森井英一* 1,4(*共同責任著者)
所属:
1.大阪大学 大学院医学系研究科 病態病理学
2.大阪大学 免疫学フロンティア研究センター(IFReC)ヒト免疫学(単一細胞ゲノミクス)
3.大阪大学 微生物病研究所(RIMD)遺伝情報実験センター ゲノム解析室
4.大阪大学 先導的学際研究機構(OTRI)
DOI: https://doi.org/10.1002/path.6064
本研究は、日本学術振興会科学研究費補助金 基盤研究(B) 研究課題 「慢性炎症を基盤としたリプログラミングの可視化と腫瘍の解析」、AMED「次世代治療・診断実現のための創薬基盤技術開発事業」の一環として行われました。また、大阪大学 免疫学フロンティア研究センター /大阪大学 微生物病研究所の奥崎大介特任准教授(常勤)の協力を得て行われました。
【用語説明】
(※1)プラチナ抵抗性
これまでは腫瘍の増殖抑制に効果的であったプラチナ製剤に対して、癌細胞が耐性を獲得したと考えられる時に使用される。現在のガイドラインでの定義では、最終のプラチナ製剤使用から6ヵ月以内に、再発が認められた時に使用される用語。
(※2)SWI/SNF 複合体
約15個のタンパク質で構成される分子機構。アデノシン三リン酸(ATP)の分解で得られるエネルギーを用いて細胞のDNA収納状態(クロマチン構造)を変化させることにより、遺伝子発現を制御する。SMARCA4とSMARCA2 はこの分子機構の中でATPを分解する役割を担っている。
(※3)線維芽細胞増殖因子(FGF)シグナル
線維芽細胞増殖因子(FGF)と呼ばれる成長因子の刺激により活性化される一連の細胞内連鎖反応。FGFシグナルを担う具体的な反応経路のひとつがマイトジェン活性化プロテインキナーゼ(MAPK)経路である。MAPK経路では最終的にERKと呼ばれる転写因子がリン酸化・核内移行して細胞の機能に変化をもたらす。
(※4)抗アポトーシス分子
細胞には自死するシステムが備わっており、これをアポトーシスと言う。プラチナ系抗がん剤はDNAに損傷を与えることでがん細胞を自死に導くため、アポトーシス抵抗性はプラチナ抵抗性と関連する。アポトーシスを抑制する分子群を抗アポトーシス分子と呼び、BCL2、BCL-xL、MCL1などが知られている。
(※5)ペミガチニブ
FGF受容体を選択的に阻害する薬剤。既に臨床応用が為されている薬剤で、本邦でも2021年に承認された。現在はがん化学療法後に増悪したFGFR2融合遺伝子陽性の治癒切除不能な胆道がんに対して適応がある。
【城戸完介さん(博士課程)のコメント】
今回の研究は卵巣がんの病理組織標本を丹念に観察し、何百・何千というがん細胞のタンパク質の発現パターンを1細胞(シングルセル)レベルで詳細に検証することから始まりました。日々根気強く、病理組織と向き合う中で培われた病理医の目をもって、現在・未来のがん医療に少しでも貢献できれば幸いです。
(参考URL)
・野島准教授 研究者総覧
https://rd.iai.osaka-u.ac.jp/ja/a88924bb629655e8.html?k=%E9%87%8E%E5%B3%B6%E8%81%A1