III型分泌装置阻害剤aurodoxの作用標的をPurAと同定–北里大学
北里大学大村智記念研究所の大村智特別栄誉教授、浅見行弘教授、阿部章夫教授、渡邊善洋特任助教、君嶋葵講師、薬学部の羽田健講師らと、東北大学大学院薬学研究科の岩渕好治教授、星薬科大学薬学部・医薬品化学研究所の叶直樹教授らの研究チームは、グラム陰性病原性細菌に高度に保存されているIII型分泌装置 (T3SS) の阻害剤であるaurodox の作用標的同定に関する研究を行った。
この研究では、aurodoxがアデニロコハク酸合成酵素 (PurA) に結合し、T3SSからの分泌タンパク質の産生を抑制することを明らかにした。また、in vitroおよびin vivo実験の両方で、purAを破壊した細菌の病原性が著しく低下したことなどから、aurodoxの作用標的をPurAと同定した。今回の発見は、T3SSの機能におけるPurAの重要性を示唆するとともに、aurodoxの創薬シードとしての可能性と、抗感染症薬やワクチン開発の標的としてのPurAの新たな道を開くものである。
本研究成果は2024年4月19日に学術誌 Proceedings of the National Academy of Sciences of the United States of America (PNAS) に公開された。
本研究成果は2024年4月19日に学術誌 Proceedings of the National Academy of Sciences of the United States of America (PNAS) に公開された。
■研究の背景
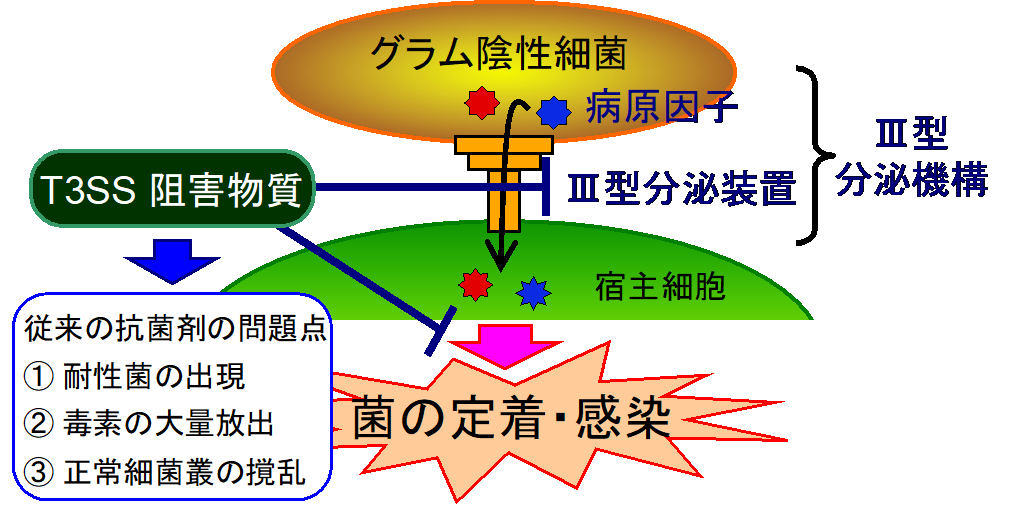
薬剤耐性 (Antimicrobial resistance: AMR) は、人類の健康にとって最大の脅威のひとつである。AMRの出現と新薬開発の間の絶えることのない戦いは、従来の抗菌薬によるアプローチが続く限り、止めることは極めて困難である。カルバペネム耐性腸内細菌科細菌などの多剤耐性グラム陰性菌は、ほとんどのメロペネムやカルバペネム系抗菌薬および広域スペクトルを有するβ-ラクタム薬に対しても耐性を持つことが知られており、その感染症の治療は困難である。この問題を克服するために、本研究チームは、多くのグラム陰性病原性細菌に高度に保存されているIII型分泌装置 (Type III secretion system: T3SS) に着目した。T3SSは、病原因子を宿主細胞への注入を担っている病原細菌の装置 (仕組み) であり、細菌の病原性発揮には必要不可欠であるが、生存には必須ではないことが知られている。したがって、T3SS阻害剤は、治療抵抗性株に対する進化的選択圧を劇的に減少させる革新的な抗感染症薬となりうる (図1)。このコンセプトに基づき、本研究グループは独自のスクリーニング系を用いて、ポリケチド系天然化合物であるaurodoxをT3SS阻害剤として同定した。Aurodoxは、腸管病原性大腸菌 (enteropathogenic Escherichia coli: EPEC) の生育を阻害する濃度よりも33倍低い濃度でT3SSに依存した赤血球の溶血作用を阻害した (図2)。
薬剤耐性 (Antimicrobial resistance: AMR) は、人類の健康にとって最大の脅威のひとつである。AMRの出現と新薬開発の間の絶えることのない戦いは、従来の抗菌薬によるアプローチが続く限り、止めることは極めて困難である。カルバペネム耐性腸内細菌科細菌などの多剤耐性グラム陰性菌は、ほとんどのメロペネムやカルバペネム系抗菌薬および広域スペクトルを有するβ-ラクタム薬に対しても耐性を持つことが知られており、その感染症の治療は困難である。この問題を克服するために、本研究チームは、多くのグラム陰性病原性細菌に高度に保存されているIII型分泌装置 (Type III secretion system: T3SS) に着目した。T3SSは、病原因子を宿主細胞への注入を担っている病原細菌の装置 (仕組み) であり、細菌の病原性発揮には必要不可欠であるが、生存には必須ではないことが知られている。したがって、T3SS阻害剤は、治療抵抗性株に対する進化的選択圧を劇的に減少させる革新的な抗感染症薬となりうる (図1)。このコンセプトに基づき、本研究グループは独自のスクリーニング系を用いて、ポリケチド系天然化合物であるaurodoxをT3SS阻害剤として同定した。Aurodoxは、腸管病原性大腸菌 (enteropathogenic Escherichia coli: EPEC) の生育を阻害する濃度よりも33倍低い濃度でT3SSに依存した赤血球の溶血作用を阻害した (図2)。
また、T3SSを保有するCitrobacter rodentium (CR) 感染マウスモデルを用いたin vivo感染実験において、aurodoxを経口投与したマウスは致死的な感染症に罹患しても生存することを明らかにし、微生物由来のaurodoxがT3SS阻害を介して治療効果を発揮することを世界で初めてin vivoで実証した。
このように、aurodoxは新しい抗感染症薬として期待されていたが、aurodoxの作用標的は不明なままであった。
このように、aurodoxは新しい抗感染症薬として期待されていたが、aurodoxの作用標的は不明なままであった。
■研究の成果
本研究チームはまず、aurodoxを固定化した開裂型・光親和型低分子固定化アガロースビーズ (cleavable photoactivatable linker-coated agarose beads) を用いてaurodox結合タンパク質を探索した。その結果、既知の因子に加えて、新たにアデニロコハク酸合成酵素 (PurA) を同定した。また、ビオチン化aurodoxプローブを設計・合成し、PurAとaurodoxの直接的結合を検証した結果、aurodoxがPurAに対して強く結合すること (KD = 6.5×10-7 M) を見出した。
次に、CRマウス感染モデルを用いたin vivo試験を行った。purAを破壊したCR株を感染させたマウスでは、感染5日目および9日目に糞便よりCRは検出されず、マウス腸内への菌の定着がCR野生株と比較して著しく低減された一方、purA相補株においては菌の定着が部分的に回復することを示した (図3)。またpurA破壊株を感染させたマウスは、観察期間である感染後28日まで全て生存したのに対し、野生株、purA相補株を感染させたマウスは、それぞれ12日目、18日目までに全て死亡した (図4)。以上の結果より、PurAはT3SSを制御することで細菌の病原性に関与することが示された。さらにサルモネラにおいてもpurA破壊株で病原性が著しく低下したことから、PurAがT3SSを有する細菌の病原性発現に普遍的に関わっている可能性、およびaurodoxがT3SSを有する病原細菌に対する新たな抗感染症薬となる可能性を示した。
本研究チームはまず、aurodoxを固定化した開裂型・光親和型低分子固定化アガロースビーズ (cleavable photoactivatable linker-coated agarose beads) を用いてaurodox結合タンパク質を探索した。その結果、既知の因子に加えて、新たにアデニロコハク酸合成酵素 (PurA) を同定した。また、ビオチン化aurodoxプローブを設計・合成し、PurAとaurodoxの直接的結合を検証した結果、aurodoxがPurAに対して強く結合すること (KD = 6.5×10-7 M) を見出した。
次に、CRマウス感染モデルを用いたin vivo試験を行った。purAを破壊したCR株を感染させたマウスでは、感染5日目および9日目に糞便よりCRは検出されず、マウス腸内への菌の定着がCR野生株と比較して著しく低減された一方、purA相補株においては菌の定着が部分的に回復することを示した (図3)。またpurA破壊株を感染させたマウスは、観察期間である感染後28日まで全て生存したのに対し、野生株、purA相補株を感染させたマウスは、それぞれ12日目、18日目までに全て死亡した (図4)。以上の結果より、PurAはT3SSを制御することで細菌の病原性に関与することが示された。さらにサルモネラにおいてもpurA破壊株で病原性が著しく低下したことから、PurAがT3SSを有する細菌の病原性発現に普遍的に関わっている可能性、およびaurodoxがT3SSを有する病原細菌に対する新たな抗感染症薬となる可能性を示した。
■今後の展望
今回の発見は、T3SSの機能におけるPurAの重要性を示唆するとともに、aurodoxの創薬シードとしての可能性と、抗感染症薬やワクチン開発の標的としてのPurAの新たな道を開くものである。
■用語解説
・Ⅲ型分泌装置 (T3SS):
腸内細菌科細菌 (腸管出血性大腸菌、腸管病原性大腸菌、サルモネラ属菌、赤痢菌など) 、ボルデテラ属細菌、植物病原菌などに高度に保存されており、病原菌の宿主への感染過程においてエフェクターと呼ばれる病原因子を宿主に移行させるタンパク質複合体。T3SS は菌の生存に必須ではないことが知られている。
・Aurodox:
・Aurodox:
放線菌streptomyces sp. が生産するポリケチド系抗生物質。細菌の翻訳伸長因子EF-Tuに結合し作用することが知られていた。今回、我々は、aurodoxがPurAにも結合し、細菌のT3SSを阻害することを新たに見出した。
・アデニロコハク酸合成酵素 (PurA):
・アデニロコハク酸合成酵素 (PurA):
イノシン酸 (IMP) からアデノシンモノリン酸 (AMP) の合成を行う際の中間体であるアデニロコハク酸を合成する1次代謝酵素。プリンヌクレオチドの生産に関与している。様々な生物に保存されている。
・Citrobacter rodentium (CR):
・Citrobacter rodentium (CR):
T3SSを有するグラム陰性細菌。齧歯類に感染する。
・開裂型・光親和型低分子固定化アガロースビーズ:
・開裂型・光親和型低分子固定化アガロースビーズ:
365 nmの光照射で発生する高反応性中間体を利用して、低分子化合物を固定化できるアフィニティー樹脂担体。リンカー分子中にジスルフィド結合を有しており、標的タンパク質と共有結合を形成する化合物の標的同定に特に有効である。
■論文情報
掲載誌:Proceedings of the National Academy of Sciences of the United States of America (PNAS)
論文名:PurA is the main target of aurodox, a type III secretion system inhibitor
著 者:渡邊善洋、羽田健、君嶋葵、桑江朝臣、須賀拓弥、鈴木貴大、岩渕好治、本庄雅子、
本間颯太、岩月正人、松井秀仁、花木秀明、叶直樹、阿部章夫、浅見行弘、大村智
DOI:10.1073/pnas.2322363121
■問い合わせ先
【研究に関すること】
・北里大学大村智記念研究所
教授 浅見行弘
e-mail:yasami@lisci.kitasato-u.ac.jp
・北里大学大村智記念研究所
特任助教 渡邊善洋
e-mail:yosiwata@lisci.kitasato-u.ac.jp
【報道に関すること】
学校法人北里研究所 総務部広報課
TEL:03-5791-6422
E-mail:kohoh@kitasato-u.ac.jp
学校法人北里研究所 総務部広報課
TEL:03-5791-6422
E-mail:kohoh@kitasato-u.ac.jp