【東京医科大学】心筋梗塞におけるステント留置後の再狭窄にプロスタグランディンE受容体EP4によるFibulin-1の産生亢進が関与 ~内膜肥厚形成を抑制する新たな治療戦略となる可能性を示唆~
この研究成果は、2024年9月22日、国際雑誌「Cardiovascular Research」に掲載されました。
東京医科大学(学長:宮澤啓介/東京都新宿区)、細胞生理学分野 横山詩子主任教授、救急・災害医学分野 奥村滋邦助教らの研究グループは、心筋梗塞におけるステント留置の後期合併症であるステント内再狭窄に、プロスタグランディンE(PGE₂)受容体EP4シグナルによる糖蛋白fibulin-1の産生亢進が関与することを明らかにしました。
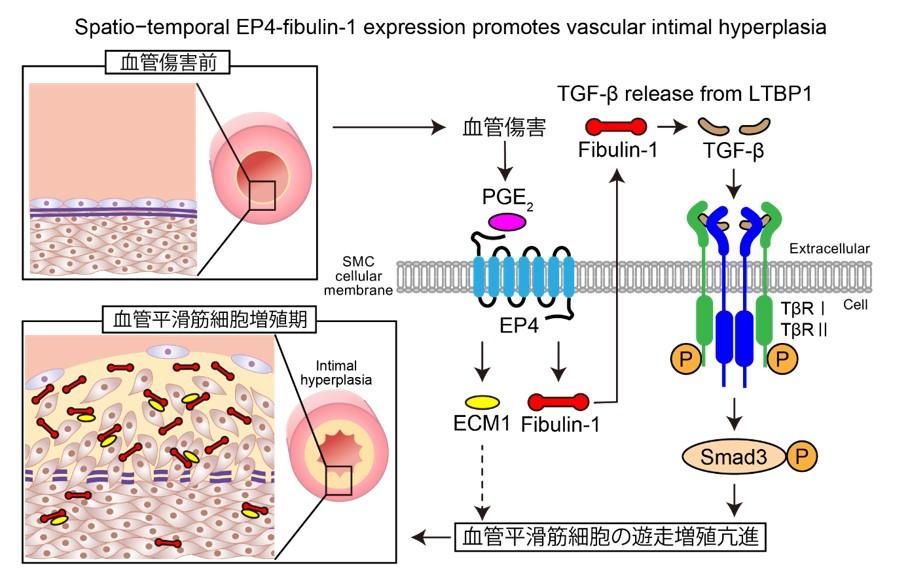
我々はEP4レポーターマウスを用いて、大腿動脈における血管傷害後2週で内膜肥厚部の血管平滑筋細胞に顕著にEP4とfibulin-1の発現が顕著に増加することを見出しました。EP4ヘテロ接合体欠損マウス、EP4過剰発現マウス、及びfibulin-1欠損マウスを用いて、EP4刺激により増加したfibulin-1はTGF-β/Smad3を介して血管平滑筋細胞の遊走増殖を促進することを明らかにしました。さらにEP4阻害薬の経口投与は、野生型マウスの血管傷害後の内膜肥厚を減少させることがわかりました。
薬剤溶出ステントの進歩は、血管の内膜肥厚形成の減少に大きく貢献していますが、いまだ治療効果は十分とはいえません。今回の研究によりEP4アンタゴニストの経口あるいは局所投与、fibulin-1のダウンレギュレーションは内膜肥厚形成を抑制する新たな治療戦略となる可能性が示されました。
この研究成果は、2024年9月22日、国際雑誌「Cardiovascular Research」に掲載されました。
【本研究のポイント】
● PGE₂受容体であるEP4がTGF-β/Smad3を介してfibulin-1を増加させ、血管平滑筋細胞の遊走増殖を促進し内膜肥厚を形成させる。
● EP4アンタゴニストの経口投与は血管傷害後の内膜肥厚形成を抑制する。
血管再狭窄は、バルーン血管形成術やステント留置術などの機械的損傷に対する創傷治癒反応です。シロリムスなど血管平滑筋の細胞増殖を抑える薬剤をステントに塗布した薬剤溶出ステント (DES) は再狭窄の割合を大幅に減少しました。しかしながら、ステント再狭窄は依然として全患者の約5-10%で発生しており、再狭窄後の根本的な治療がないこと、再狭窄がおこるメカニズムが完全に解明されていないことが問題となっています。
PGE₂が血管再狭窄を増悪することは知られており、その産生酵素であるCOX-2の阻害は動物およびヒトにおいて内膜肥厚形成を抑制します。しかしながら、COX-2阻害薬は胃潰瘍や血栓性塞栓などの心血管系への副作用のため治療薬として長期に用いることはできません。そのため新たな治療戦略としてPGE₂よりさらに下流のメカニズム、つまりPGE₂受容体とその作用機序を解明することで副作用が少なく、かつ内膜肥厚を抑制する薬を開発できる可能性があると考えました。
【本研究で得られた結果・知見】
血管傷害部位ではプロスタグランディンEが産生されていることが知られていますが、その受容体の時空間的な発現パターンは明らかにされていなかったことから、本研究ではPGE₂の下流にあるEP4に着目し、EP4の時空間的発現、さらにはその下流にある分子メカニズムを解明することを目的としました。我々の研究室ではEP4レポーターマウス(Ptger4-IRES-nlsLacZ)を新たに作製し、EP4の発現を可視化することで大腿動脈ワイヤー損傷後2週に内膜肥厚部の血管平滑筋細胞にEP4が高発現することを見出しました。この時期は平滑筋細胞の増殖により内膜肥厚形成が亢進しています。また、網羅的遺伝子解析より血管平滑筋細胞においてPGE₂-EP4刺激はfibulin-1を顕著に増加していることがわかりました。EP4ヘテロ接合体欠損マウス(Ptger4fl/+;SM22-Cre)(注:fl/+は上付き)、EP4過大発現マウス(Ptger4-Tg)、Fibulin-1欠損マウス(Fbln1fl/fl;SM22-Cre)(注:fl/flは上付き)を用いることで、血管傷害部位で産生されるPGE₂はEP4を刺激してfibulin-1を増加させ、TGF-β/Smad3シグナルを介して血管平滑筋細胞の遊走増殖を促進させて内膜肥厚形成を促進することを明らかにしました。また、EP4アンタゴニストの全身投与は血管損傷後の内膜肥厚を減少させることがわかりました。
今回の研究によりEP4アンタゴニストの経口、局所投与、あるいはfibulin-1のダウンレギュレーションは内膜肥厚形成を抑制する可能性が示され、ステント内再狭窄に対する新たな治療戦略となることが期待されます。
【論文情報】
タイトル:Spatiotemporal EP4-fibulin-1 expression is associated with vascular intimal hyperplasia
著 者:Shigekuni Okumura, Sayuki Oka, Takako Sasaki, Marion A. Cooley, Yuko Hidaka, Hana Inoue, Hitoshi Nishijima, Shin-Ichiro Ohno, Shota Tanifuji, Mari Kaneko, Takaya Abe, Masahiko Kuroda, Tadashi Yokosuka, Richard M. Breyer, Hiroshi Homma, Yuko Kato, Utako Yokoyama*(*:責任著者)
掲載誌名:Cardiovascular Research
DOI:10.1093/cvr/cvae211
【主な競争的研究資金】
【細胞生理学分野ホームページ】
https://tokyo-med-physiology.jimdofree.com/
【救急・災害医学分野ホームページ】
https://tokyo-med-er.jp/
本件に関するお問い合わせ先
企画部 広報・社会連携推進室
- 住所
- 〒160-8402 東京都新宿区新宿6-1-1
- TEL
- 03-3351-6141
- d-koho@tokyo-med.ac.jp