弘前大学の三木康生助教らによる研究グループがレヴィ小体型認知症や多系統萎縮症における認知症の成因を発見
日本では認知症の患者数は400万人以上と推計されており、高齢者の9人に1人が認知症を有している。認知症の多くは加齢性脳変性疾患によるもので、原因として最も多いのはアルツハイマー病だが、それに続くレヴィ小体型認知症(dementia with Lewy bodies: DLB)や多系統萎縮症(multiple system atrophy: MSA)に見られる認知症の成因については充分にわかっていなかった。
そこで今回、弘前大学(三木康生助教・若林孝一教授研究グループ)が中心となって、新潟大学、立命館大学、名古屋市立大学、University College London(イギリス)と国際共同研究チームを作り、これらの疾患における認知症の成因を実際のヒトの脳を用いて世界で初めて明らかにした。
この研究成果は、神経科学のトップジャーナルの一つである『Translational Neurodegeneration 誌』(2024 IF=15.2)に 2025(令和7)年6月23日付で掲載された。
・URL: https://translationalneurodegeneration.biomedcentral.com/articles/10.1186/s40035-025-00493-6
■本件の概要
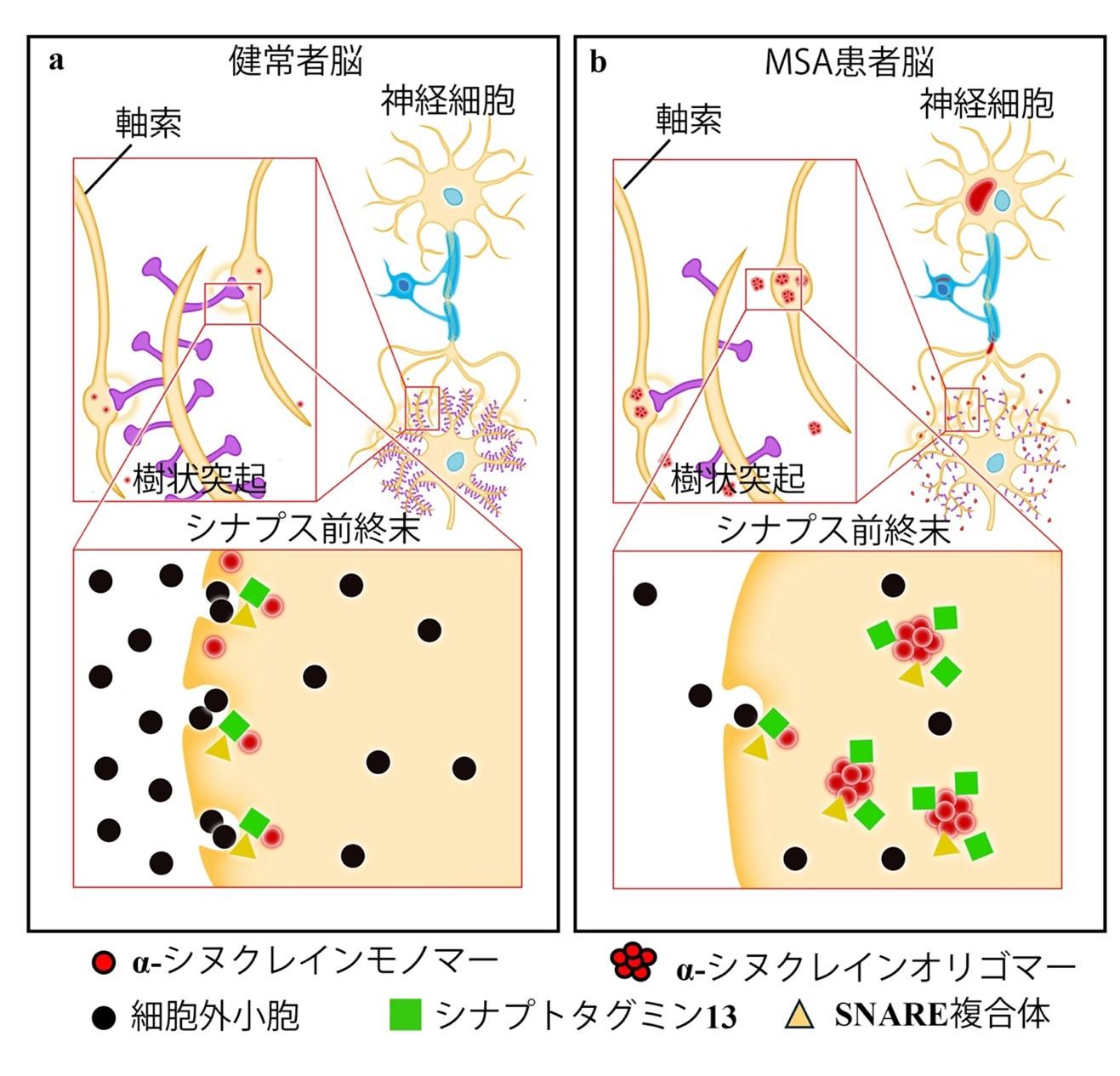
DLBやMSA患者は種々の程度の認知症を呈し、これにより生活の質を大きく損なう。これらの疾患では異常αシヌクレインというタンパク質が脳内に蓄積することが病態に関わる。三木助教・若林教授らの研究グループによる先行研究では、異常αシヌクレインの中でも特に毒性の強いαシヌクレインオリゴマーという構造がMSAの認知症の発症に関わることを報告してきた(Miki et al. Brain 2020; Miki et al. Neuropathol Appl Neurobiol 2022)。しかし、αシヌクレインオリゴマーが認知機能障害をどのように引き起こすかの詳細な分子メカニズムは、これまで判明していなかった。
そこで今回、同研究グループが世界に先駆けて樹立したMSAモデルマウス(Tanji et al. Neurobiol Dis 2019)と多数のヒト剖検脳を用いて調べたところ、以下のことが判明した(図)。
1)生理的な環境下では、αシヌクレインモノマーはシナプトタグミン13やSNARE複合体と相互作用し細胞外小胞の分泌に関わる
2)病的な状態になりαシヌクレインモノマーがαシヌクレインオリゴマーに変化すると、αシヌクレインオリゴマーがシナプトタグミン13との異常な相互作用を引き起こす
3)その結果、神経細胞の軸索末端から放出される神経伝達物質を含む細胞外小胞の放出が阻害される
神経伝達物質は細胞外小胞に含まれシナプス前終末から放出される。この神経伝達物質は脳内で情報の伝達、学習、記憶などに直接関わる重要な物質であり、これが減ることは認知症の発症に関わる。また、注目すべきは、この変化はMSAにとどまらずDLBにおいても見られ、異常αシヌクレインが蓄積する疾患に共通するメカニズムであることがわかった。
これらの所見は、DLBやMSAにおける認知症の治療において治療標的はαシヌクレインオリゴマーであることを意味している。なお、同研究グループはトレハロースやエルゴチオネインといった物質がMSAモデルマウスにおける認知症の改善に有効であることを確認しており(Tanaka et al. Brain Commun 2024; Kimura et al. Biochem Bioph ys Res Comm 2025)、αシヌクレインオリゴマーを標的とする認知症の治療戦略を進めている。
本件に関するお問い合わせ先
弘前大学
- 住所
- 青森県弘前市文京町1番地
- TEL
- 0172-39-3012
- FAX
- 0172-37-6594