- ★Google+
- ★Hatena::Bookmark
学校法人帝京大学(学長:冲永佳史)理工学部/医療技術学部の村上健次博士研究員と若林健之教授は、独立行政法人 産業技術総合研究所(理事長:野間口 有)バイオメディシナル情報研究センター上田太郎副研究センター長、国立大学法人九州工業大学(学長:松永守央)情報工学部安永卓生教授らと共同で、アクチン重合とATP分解の分子機構を解明した。
アクチン重合は細胞移動(がん細胞の浸潤)、神経繊維・神経樹状突起の伸長、脳神経ネットワーク形成、細胞分裂(がん細胞の増殖)、細胞接着(がん細胞の転移しにくさ)、筋収縮などに必須であり、重要な役割を果たすが、そのメカニズムは不明だった。
村上博士と若林教授らは、アクチンフィラメントの立体構造をクライオ電子顕微鏡で5オングストローム(1オングストロームは10のマイナス10乗メートル、または1億分の1センチメートル)の詳しさで決定し、大型のアミノ酸の可視化にも成功した。その結果、アクチン分子がアクチンフィラメントに加わると、分子間と分子内で4段階ドミノ反応が起き、ATPが分解されることをつきとめた。段階的なドミノ反応が重合、ATP分解、リン酸放出の時間差のタイマーになっており、アクチンフィラメントの一方向への伸長を促していたのである。
また、分子間ドミノ反応に関与するアミノ酸を変異させ、ATP分解過程を途中で止めて、詳しくX線結晶解析したところ、ATPを分解するメカニズムが原子レベルで明らかになった。すなわち、活性水分子の動きを制約し加水分解反応を邪魔している別の水分子があり、その制約が3段目の分子内ドミノ反応で解除され、ATP分解が実現することが分かった。
さらに、電子顕微鏡像の分解能向上の結果、フィラメントに結合したリン酸を初めて確認できた。リン酸はアクチン3分子の間の糊として働ており、リン酸がないとフィラメントはばらばらになりやすくなる理由も分かった。細胞内には必ずリン酸イオンがある。分解能向上には、日本発の先端技術を駆使した。冷電界放出型電子銃(日立製作所)からの高コヒーレンス電子ビームと、浜松ホトニクス社製作の特殊蛍光板(エピタキシャル成長蛍光物質)を組み込んだCCDカメラである。
アクチン重合にマグネシウムが必須な理由は、半世紀以上謎だった。マグネシウムも可視化でき、アクチン分子の間にサンドイッチされたマグネシウムイオンが分子同士の結合を強化していることが分かった。
アクチンには柔軟なループが多い。DNA分解酵素と結合するループが、別の分子のプロリンを多く含むループを引っ張り(分子間ドミノ)、ATP分解のための次の分子内ドミノを倒していた。
このようにアクチン重合のメカニズムが原子レベルで解明されたので、がん細胞の浸潤、増殖、転移などを防ぐための、新しいタイプの新薬開発にインパクトを与えると思われる。アクチン重合は神経細胞での記憶形成に関与するとされており、脳科学の発展にも寄与すると期待される。
なお、この研究の詳細は2010年10月15日に米科学誌「Cell」に掲載された。
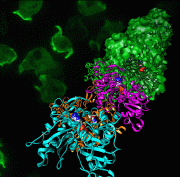
※図解説:
アクチンフィラメントの原子モデル(手前側のリボン模型)とクライオ電子顕微鏡像から再構成された立体像(奥側の表面模型)。ATPは実体模型で示されている(アクチンフィラメントは手前側に優先的に伸びる)。背景は細胞性粘菌で発現させたアクチンフィラメントの蛍光像(GFP融合アクチン)で細胞が移動する先端に集中していることが見て取れる。
▼本件に関する問い合わせ先
学校法人 帝京大学 理工学部/医療技術学部 教授 若林 健之
〒320-8551 宇都宮市豊郷台1-1
TEL: 028-627-7270、080-1000-0691
E-mail: wakabayashi◎nasu.bio.teikyo-u.ac.jp
(注)◎は「@」(アットマーク)を示します。