遺伝性神経難病発症のしくみを解明。治療法開発に道――東京薬科大学
【研究の背景】
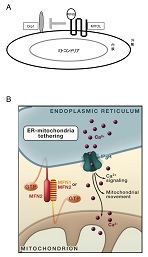
近年のイメージング解析技術の進歩により、ミトコンドリアの動的な移動や、小胞体などの他のオルガネラとの会合と解離現象が見出され、その生理的重要性が注目されている。柳教授らは以前の研究によってミトコンドリア外膜を4回貫通するユビキチンリガーゼMITOLを同定し、MITOLがミトコンドリアの分裂因子であるDrp1の分解を促進することによってミトコンドリアの形態を制御することなどを報告した(図1A)。しかしながらMITOLの役割は未だ不明なところが多く、実際にMITOLの機能を抑制すると、ミトコンドリアの動きは止まり、小胞体との相互作用も阻害されることが観察されていた。このメカニズムを解明するためにMITOLの結合タンパク質を検索したところ、ミトコンドリア外膜の融合因子であるMfn2が同定された。Mfn2は小胞体膜上にも局在し、ミトコンドリア外膜上のMfn2と手をつなぐことにより、両オルガネラを繋ぎとめている(図1B)。ミトコンドリアと小胞体は、可逆的に会合と解離を繰り返しており、中でもミトコンドリアと小胞体の接着点はmitochondria-associated ER membrane: MAMと呼ばれ、脂質の生合成や小胞体-ミトコンドリア間のカルシウム伝達などに重要な役割を果たしていることが知られている。今回、柳教授らはMITOL によるMfn2の活性制御機構とMAM形成への影響について解析した。
【研究成果】
1.MITOLはMfn2をユビキチン化しMfn2を活性化する
柳教授らは、MITOLがミトコンドリアと小胞体の接着点であるMAMにも局在していることを解明したため、Mfn2との会合について解析を行ったところ、MITOLは小胞体に局在するMfn2ではなく、ミトコンドリアに局在するMfn2と会合してユビキチン化することがわかった(図2)。結合部位を詳細に調べた結果、MITOLの基質認識領域であるC末端がMfn2のHR1ドメインと特異的に認識して結合することがわかった。MITOLはミトコンドリアに局在するMfn2をユビキチン化するが、意外なことに、MITOLによるMfn2のユビキチン化は、Mfn2の分解を促進するのではなく、Mfn2 のGTP結合能力を上昇させてMfn2を活性化し、Mfn2の重合を誘導することがわかった(図3)。MITOLの機能を抑制するとMfn2の活性化が抑制されてMfn2の重合を阻害することが示された。
2.MITOLの機能抑制によりミトコンドリアと小胞体の接着形成が抑制される
MITOLの発現を安抑制したHeLa細胞(sh MITOL)において、小胞体とミトコンドリアの接着領域MAMが有意に減少することが確かめられた(図4A)。また、ヒスタミン刺激後のミトコンドリア内のカルシウムイオン濃度の変化を観察したところ、sh MITOLではコントロール細胞に比べてカルシウムイオン濃度の上昇が著しく抑制されることを見出した(図4B)。ミトコンドリアのカルシウム取り込みに対する感受性は鈍いので、効率よく取り込むためには、MAMを形成して小胞体のカルシウム吹き出し口に近接する必要がある。したがって、sh MITOLではMfn2の複合体形成ができないためにMAMの形成不全が起こり、ミトコンドリアが小胞体から効率よくカルシウムを取り込めなかったと考えられる。
3.MITOLによるMfn2の制御機構モデル
柳教授らは、MITOLによるMfn2の活性化を介した小胞体とミトコンドリアの接着制御という新たなモデルを提唱した(図4C)。MITOLはミトコンドリアに局在するMfn2と会合してMfn2の192番目のリジンを特異的にポリユビキチンする。ポリユビキチン化されたMfn2はGTP結合能力が上昇して活性化し、Mfn2の重合と複合体形成を起こす。その結果、ミトコンドリアのMfn2と小胞体のMfn2が手を繋ぐことによってミトコンドリアと小胞体の接着が起こる。
【今後の展望】
Mfn2は神経難病の原因の一つとして、その機能調節の解明が期待されていた。本研究によりMfn2の活性化機構が明らかとなり、病態解明と治療法の開発につながることが期待できる。さらにミトコンドリアと小胞体の接着点は、脂質の生合成やカルシウム伝達など細胞機能において重要な役割を果たしており、この機能の破綻がアルツハイマー病などの神経変性疾患をはじめさまざまな病気と密接に関与していることがこれまで多数報告されている。本研究によってミトコンドリアと小胞体の接着機構の一端が解明されたことより、関連する多くの疾患への病態理解と治療開発につながることが期待される。
▼内容についてのお問い合わせ
東京薬科大学 生命科学部
分子生化学研究室 教授 柳 茂(やなぎ・しげる)
TEL: 042-676-7146
FAX: 042-676-7149
E-mail: syanagi@toyaku.ac.jp
研究室URL http://logos.ls.toyaku.ac.jp/Life-Science/lmb-8/
▼取材のお問い合わせ
東京薬科大学 総務課(法人・広報担当)
大坪、松本、葛西
TEL: 042-676-1649
FAX: 042-677-1639
E-Mail: kouho@toyaku.ac.jp
〒192-0392 東京都八王子市堀之内1432-1