昭和大学などの研究グループがパーキンソン病の原因タンパクであるα-シヌクレインの高分子オリゴマーによる細胞傷害機序の一端を解明
これまでの研究では主に細胞内で凝集し蓄積するαS凝集体が着目され、ミトコンドリアなどの細胞小器官を介して発揮する細胞毒性が証明されてきました。一方で近年、αSは細胞外にも放出され、細胞間を伝播することが明らかになってきました。しかしながら、細胞外に存在するαS自体に細胞毒性があるか、もしくはその傷害機序については解明されていませんでした。
本研究ではヒト神経芽細胞腫およびラットの神経細胞に対して、低分子αS(LMW-αS)および高分子αSオリゴマー(HMW-αSo)を細胞外から曝露し、HMW-αSoの毒性および細胞膜損傷を介した神経細胞死誘導機序を明らかにし、PDの発症に関わる細胞傷害機序の一端を明らかにしました。これらの知見から、細胞外HMW-αSoを標的とした抗体療法が疾患修飾療法として有用であることが期待されます。
本研究成果は、2023年9月28日(米国東部時間)に国際学術誌『npj Parkinson’s Disease』のオンライン版に掲載されました。
【研究の背景・目的】
PDはアルツハイマー型認知症に次いで2番目に多い神経変性疾患であり、運動緩慢や静止時振戦、筋強剛などのパーキンソニズム、および様々な非運動症状を特徴とする疾患です。PDではレヴィ小体という細胞内封入体の存在を病理学的特徴として、その主要構造物がαSというタンパクであることが知られています。αSは単量体から多量体へと凝集する過程で細胞毒性を発揮し、最終的にはレヴィ小体という細胞内封入体を形成しますが、中でも早期あるいは中間凝集段階であるオリゴマーやプロトフィブリルが細胞毒性をもつことが示唆されています(関連文献1)。また、凝集したαSは細胞外へ放出され、隣接する細胞へと伝播すると推定されています。
これまで、細胞内に蓄積したαSによるミトコンドリアを介した内因性アポトーシス誘導は報告されていますが(関連文献2)、細胞外環境のαSによる直接的な細胞傷害機序は解明されていませんでした。そこで本研究では、細胞外からLMW-αSおよびHMW-αSoを曝露した際の、細胞膜傷害作用および細胞死誘導機序の解明を目的としました。
【研究成果の概要】
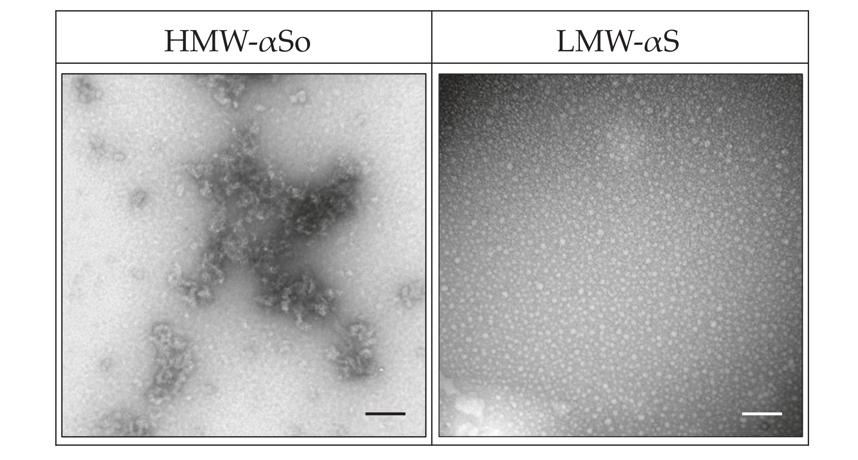
ヒトαSペプチドをインキュベーションした後に、サイズ排除クロマトグラフィーによりHMW-αSoを分取し、電子顕微鏡を用いてタンパクを観察しました(図1)。HMW-αSoはビーズ状に連なる形態を示し、以前に報告されたプロトフィブリルの形態と一致しました(関連文献3)。細胞株としては分化誘導したヒト神経芽細胞腫(SH−SY5Y細胞)およびWistar Rat新生児の大脳皮質から単離した神経細胞にこれらのαSを用いました。そして、それぞれのαSを処置した細胞における細胞毒性、酸化ストレス(活性酸素種の生成、細胞膜リン脂質過酸化)、細胞内Ca2+の変動、Flow cytometryによるアポトーシス細胞検出を測定しました。
結果として、HMW-αSoはLMW-αSに比べて酸化ストレスを誘導し、細胞膜リン脂質を過酸化させました(図2)。さらに、HMW-αSoは細胞膜に内在するCa2+チャネルを傷害することで、細胞外からのCa2+の持続的流入を誘導しました(図3)。HMW-αSo曝露によってアポトーシス細胞が増加し、caspase-3・8の活性上昇することより、細胞膜を起点とした外因性アポトーシスが誘導されることが示されました(図4)。これまで、αSは細胞内で凝集する過程で毒性を発揮していく過程に注目されていましたが、今回の研究ではそれに加える新たな機序として、細胞外に存在するHMW-αSoが直接、細胞膜障害を誘導することで、神経細胞死を誘導することを発見しました。
【今後の展開】
αSは細胞内にとどまるだけでなく、細胞外へと放出されて細胞間を伝播するタンパクです。本研究によって細胞外に存在しているαSも直接細胞膜への傷害作用をもち、神経細胞死を誘導していくことが示されました。2023年1月にアルツハイマー病に対する疾患修飾療法として、抗アミロイドβプロトフィブリル抗体であるレカネマブが米国FDAで承認され、本邦においても2023年9月25日厚生労働省により正式に承認されました。PDにおいてもプロトフィブリルやオリゴマーを標的とした抗体療法は盛んに研究が進められています。今回の研究は、PDの発症に関わる細胞傷害機序の一端を明らかにし、細胞外αSを標的とした抗体療法をより支持する証拠となります。本研究成果は今後のPDのさらなる新規根本治療薬の開発にも役立つものと期待されます。
【用語解説】
※1:パーキンソン病(PD)(Parkinson’s disease)
脳内のドパミン神経細胞が減ってしまうことで発症する神経変性疾患です。動作が遅くなり、手足の振るえや筋肉のこわばり、などの運動症状を伴います。さらに自律神経障害や睡眠障害、精神症状などのさまざまな非運動症状を認めることも特徴です。
※2:α-シヌクレイン(αS)(α-Synuclein)
αSはSNCA遺伝子にコードされた分子量14 kDa、140アミノ酸から構成されるタンパク質です。脳可溶性タンパクの約1%を占めておりヒト脳内に豊富に存在していますが、凝集・蓄積することによって、神経細胞毒性をもつと考えられています。
※3:プロトフィブリル
αSの凝集過程(モノマー→線維)における中間段階で高分子オリゴマーの範疇に含まれます。
【掲載論文】
・雑誌名:npj Parkinson’s Disease
・論文名:Extracellular high molecular weight α-synuclein oligomers induce cell death by disrupting the plasma membrane
(細胞外α-シヌクレイン高分子 オリゴマーは細胞膜障害を介して細胞毒性をもたらす)
・著者名:Naohito Ito、Mayumi Tsuji、Naoki Adachi、Shiro Nakamura、Avijite Kumer Sarkar、 Kensuke Ikenaka、Cesar Aguirre、Atsushi Michael Kimura、Yuji Kiuchi、Hideki Mochizuki、David B. Teplow、Kenjiro Ono
(井藤尚仁、辻まゆみ、安達直樹、中村史朗、アビジット・クマール・サルカル、池中健介、セサール・アギーレ、木村篤史、木内祐二、望月秀樹、デービッド・ビー・テプロフ、 小野賢二郎)
・掲載日時:2023年9月28日(米国東部時間)
・DOI:10.1038/s41531-023-00583-0
https://www.nature.com/articles/s41531-023-00583-0
【関連文献】
1. Ono, K. The oligomer hypothesis in α-synucleinopathy. Neurochem. Res. 42, 3362-3371 (2017).
2. Yasuda, T., Nakata, Y. & Mochizuki, H. α-Synuclein and neuronal cell death. Mol. Neurobiol. 47, 466-483 (2013).
3. Ono, K. et al. Effect of melatonin on α-synuclein self-assembly and cytotoxicity. Neurobiol. Aging 33, 2172-2185 (2012).
▼研究内容に関する問い合わせ先
・昭和大学 薬理科学研究センター 教授
辻 まゆみ(つじ まゆみ)
TEL:03-3784-8125
E-mail: tsujim@med.showa-u.ac.jp
・昭和大学 医学部内科学講座脳神経内科学部門 客員教授
金沢大学 医薬保健研究域医学系脳神経内科学 教授
小野 賢二郎(おの けんじろう)
TEL:076-265-2292
E-mail: onoken@med.showa-u.ac.jp
▼本件リリース元
学校法人 昭和大学 総務部 総務課 大学広報係
TEL: 03-3784-8059
Email: press@ofc.showa-u.ac.jp