ヒトラクトフェリンの細胞内送達によりがん細胞増殖を抑制~細胞内小器官のpHに関与、新たながん治療法など応用期待~東京工科大学大学院 バイオ・情報メディア研究科
東京工科大学(東京都八王子市、学長:香川豊)大学院 バイオ・情報メディア研究科の栗本大輔(博士課程3年)、同トルン ディン ハゥエーアン(修士課程2年)、同佐藤淳教授らの研究グループは、ヒトラクトフェリン(hLF)(注1)をがん細胞内に送達させることで、がん細胞の増殖を阻害する現象を見出しました。
hLFによるNa⁺/H⁺交換輸送体7(NHE7)(注2)の発現促進を介して、がん細胞内小器官のpH恒常性を破綻させる新たなメカニズムによるもので、新たながん治療法への応用などが期待されます。
hLFによるNa⁺/H⁺交換輸送体7(NHE7)(注2)の発現促進を介して、がん細胞内小器官のpH恒常性を破綻させる新たなメカニズムによるもので、新たながん治療法への応用などが期待されます。
本研究成果は、学術誌「Biochemical and Biophysical Research Communications」オンライン版(2024年1月5日)に掲載されました。hLFを用いたバイオ医薬品の開発は、バイオベンチャー企業の株式会社S&Kバイオファーマ(注3)において進められています。
【研究背景】
NHE7は、細胞内小器官であるトランスゴルジ網(TGN)(注4)におけるpH恒常性に関与しており、肺腺がん細胞では、TGNからH⁺を放出することでTGNのpHを弱酸性に保ち、がん細胞の増殖と生存に寄与しています。遺伝子ノックダウンによるNHE7機能阻害は、TGNのpH恒常性を破綻させることで膵臓がんの増殖を抑制したのに対して、正常細胞には影響しないことが近年報告されており、がん治療の標的となる可能性が示されています(文献1)。一方、膵臓以外のがん種に対する効果は不明でした。佐藤淳教授らは、ヒト血清アルブミン(HSA)をhLFに融合させたhLF-HSAは、がん細胞内への取り込みが向上し、その抗腫瘍活性が増強することを発見しています(注5)。本研究では、HSA融合により細胞内に送達されたhLFの誘導する抗腫瘍活性に関して、NHE7の関与をヒト肺腺がん細胞で検証しました。
【研究成果】
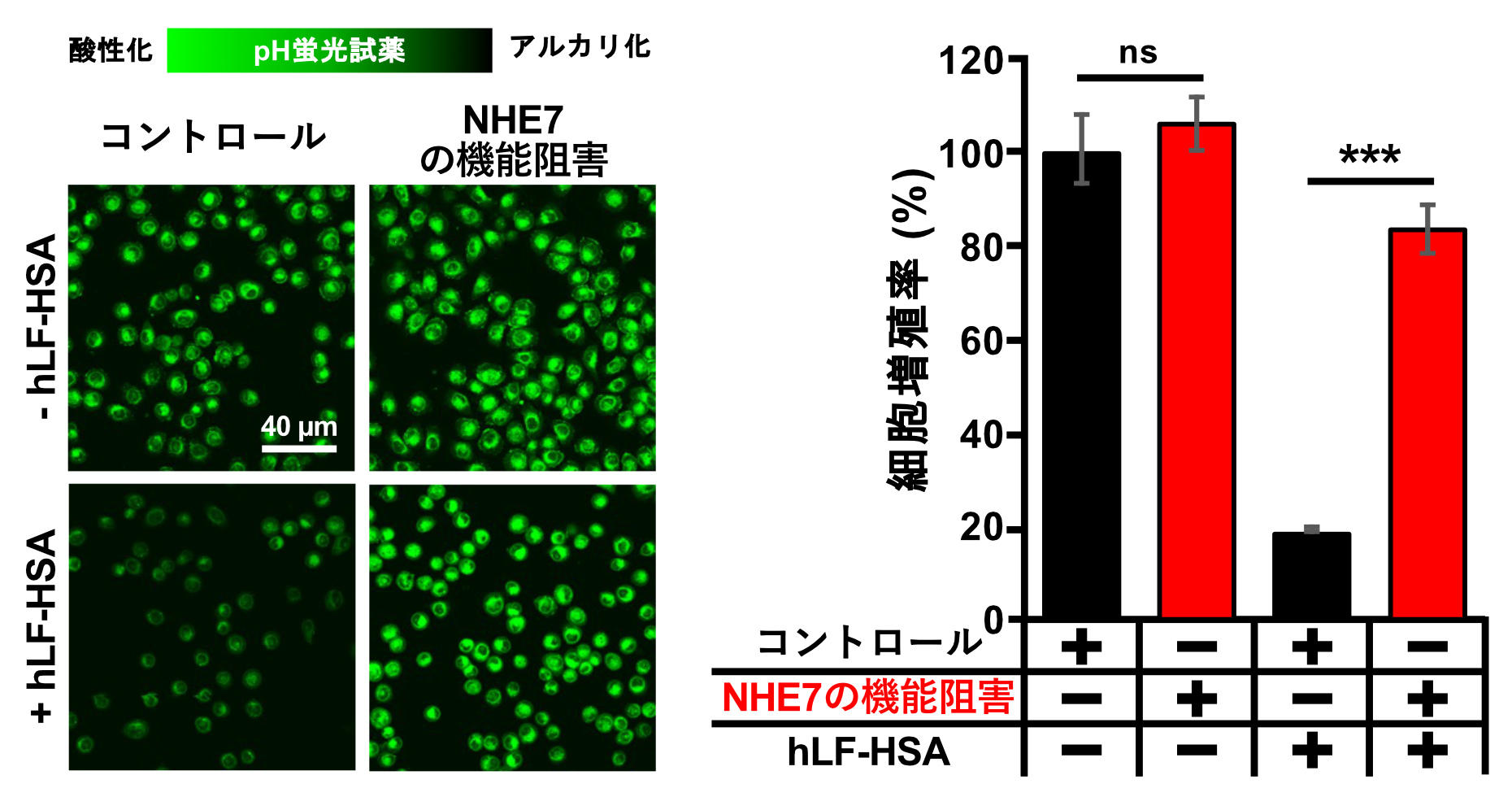
hLF-HSAは、肺腺がんの細胞内小器官を弱酸性からアルカリ化し、その増殖を阻害しました(図1)。一方、hLF-HSAによる細胞内小器官のアルカリ化及び細胞増殖阻害は、遺伝子ノックダウンによるNHE7機能阻害により著しく減弱したことから(図1A,B)、NHE7がその標的分子であることが示されました。hLF-HSA処理により、NHE7の発現量が上昇したことから、hLF-HSAは、TGNで機能するNHE7の発現量を高めることでTGNをアルカリ化し、がんの増殖を抑制することが明らかとなりました(図2)。
遺伝子ノックダウンによるNHE7機能阻害は、膵臓がんではその増殖抑制が報告されていますが、肺腺がんではその細胞増殖には影響しませんでした(図1B)。これらから、肺腺がんに対しては、NHE7ノックダウンではなく、hLF-HSAで観察されるようなNHE7機能促進による細胞内小器官pH恒常性の破綻が、その治療法として有効である可能性を示しています。またその汎用性を検証するために、hLF-HSAの膵臓がん細胞の増殖に対する影響も検証したところ、肺腺がん細胞同様に細胞増殖阻害を誘導しました。hLF-HSAは、正常細胞の増殖には影響しないこともすでに報告されています(文献2)。
遺伝子ノックダウンによるNHE7機能阻害は、膵臓がんではその増殖抑制が報告されていますが、肺腺がんではその細胞増殖には影響しませんでした(図1B)。これらから、肺腺がんに対しては、NHE7ノックダウンではなく、hLF-HSAで観察されるようなNHE7機能促進による細胞内小器官pH恒常性の破綻が、その治療法として有効である可能性を示しています。またその汎用性を検証するために、hLF-HSAの膵臓がん細胞の増殖に対する影響も検証したところ、肺腺がん細胞同様に細胞増殖阻害を誘導しました。hLF-HSAは、正常細胞の増殖には影響しないこともすでに報告されています(文献2)。
【社会的・学術的なポイント】
遺伝子ノックダウンによるNHE7の機能阻害は、膵臓がん細胞の増殖を抑制しますが、正常細胞の増殖に対しては影響しないことから、近年がん治療の標的として期待されています。本研究では、NHE7ノックダウンは、ヒト肺腺がん細胞の増殖を阻害しない一方、hLF-HSAによるNHE7の発現促進は、膵臓がんと肺腺がんの両方の増殖を阻害することを見出しました。これらから、がん細胞へのhLF-HSA投与は、より有効性の高いがん治療法として期待されます。
【論文情報】
論文名: Intracellularly delivered human lactoferrin functions as an activator of Na⁺/H⁺exchanger 7
掲載誌: Biochemical and Biophysical Research Communications
掲載URL:
掲載誌: Biochemical and Biophysical Research Communications
掲載URL:
https://doi.org/10.1016/j.bbrc.2024.149480
【用語解説】
(注1) hLF:自然免疫で機能する抗腫瘍、抗炎症、抗酸化、神経再生作用など多くの生理活性を有するタンパク質
(注2) NHE7:肺腺がん細胞では、細胞内小器官からH⁺を放出することで、細胞内小器官の弱酸性を保っている
(注3) 株式会社S&Kバイオファーマ (本社:神奈川県川崎市、代表:加賀谷伸治)にて、がんや脊髄損傷、敗血症、急速進行性糸球体腎炎などの治療薬として開発
https://skagayasandk.wixsite.com/website
(注2) NHE7:肺腺がん細胞では、細胞内小器官からH⁺を放出することで、細胞内小器官の弱酸性を保っている
(注3) 株式会社S&Kバイオファーマ (本社:神奈川県川崎市、代表:加賀谷伸治)にて、がんや脊髄損傷、敗血症、急速進行性糸球体腎炎などの治療薬として開発
https://skagayasandk.wixsite.com/website
(注4) TGN:ゴルジ体の隣に位置する網目状の細胞内小器官。ゴルジ体を経由して輸送されてきたタンパク質を、目的地別に選別を行う
(注5) ヒト血清アルブミンへのヒトラクトフェリンの融合により、がん細胞への集積性が飛躍的に高まることを発見
https://doi.org/10.1016/j.ejps.2023.106591
(注5) ヒト血清アルブミンへのヒトラクトフェリンの融合により、がん細胞への集積性が飛躍的に高まることを発見
https://doi.org/10.1016/j.ejps.2023.106591
【参考文献】
(文献1) K.M.O. Galenkampら Golgi Acidification by NHE7 Regulates Cytosolic pH Homeostasis in Pancreatic Cancer Cells, Cancer Discov (2020)
(文献2) Uedaら Albumin fusion at the N-terminus or C-terminus of human lactoferrin leads to improved pharmacokinetics and anti-proliferative effects on cancer cell lines. Eur. J. Pharmaceut. Sci. (2020)
(文献2) Uedaら Albumin fusion at the N-terminus or C-terminus of human lactoferrin leads to improved pharmacokinetics and anti-proliferative effects on cancer cell lines. Eur. J. Pharmaceut. Sci. (2020)
■東京工科大学 大学院 バイオ・情報メディア研究科 佐藤 淳(⽣物創薬)研究室
遺伝子組換え、生化学、細胞培養技術を基盤とした生物創薬に関する研究を行っている。 工学的な発想で、創薬という「モノ作り」を推進している。
[主な研究テーマ]
1. 自然免疫で機能する多機能性タンパク質であるラクトフェリンの機能解析(特に抗腫瘍作用)
2. 体内安定性を高めたラクトフェリンのバイオ医薬品としての開発(がん、脊髄損傷、敗血症など)
3. 疾患に関連する糖鎖を標的とするバイオ医薬品の開発
4. ファージディスプレイ法を用いた新規機能ペプチドの創製(hLF模倣ペプチドの開発)
【研究内容に関してのお問い合わせ先】
東京工科大学 大学院 バイオ・情報メディア研究科 佐藤淳教授
Tel 042-637-2197(研究室直通)
東京工科大学 大学院 バイオ・情報メディア研究科 佐藤淳教授
Tel 042-637-2197(研究室直通)
E-mail atsato(at)stf.teu.ac.jp
※(at)は@に置き換えてください
※(at)は@に置き換えてください