【東京薬科大学】既存肺がん治療薬クリゾチニブ新作用の発見! ~骨髄異形成症候群の血小板減少症に対して巨核球造血促進により血小板産生を増加~
・肺がん治療薬「クリゾチニブ」が巨核球造血を促進する新たな効果を発見
・クリゾチニブによるオーロラキナーゼ阻害が巨核球の成熟を促進し、血小板産生を増加させるメカニズムを解明
・骨髄異形成症候群患者の血小板減少症において特徴的な遺伝子発現プロファイルを同定
・既存薬の新たな適応(ドラッグリポジショニング)により迅速な臨床応用が期待される
現在の主な治療法である血小板輸血*4は一時的な効果しかなく、同種免疫や血小板不応性などのリスクも伴います。そのため、血小板産生を直接的に促進する新たな治療アプローチが強く求められていました。
もし in vitro*6で巨核球分化障害が再現できれば、それを改善できるような化合物が探索できます。またそのような化合物は巨核球造血を促進し、血小板数を増加させることが期待できます。そこでMDSモデルマウスの巨核球の特性を調べるため、マウス骨髄から造血幹細胞を分離し、in vitro 培養を行いました。その結果、MDSモデルマウス由来の造血幹細胞から分化した巨核球は、対照マウスと比較して有意に小型化しており、正常な巨核球に特徴的な核倍数性が顕著に減少していました。すなわちMDSマウスモデルの生体内で見られた巨核球分化障害が in vitroで再現できることがわかりました。
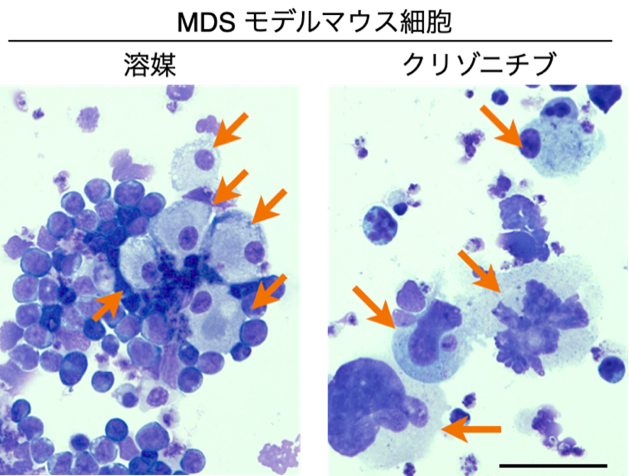
(別添)図1 クリゾニチブの巨核球分化成熟化促進効果
MDSモデルマウス由来の造血幹細胞に対して溶媒(画像左)およびクリゾチニブ(画像右)を処理し培養後、細胞の形態を観察した。オレンジ色の矢印で示した巨核球系細胞がクリゾニチブ処理により大きくなっている。出典:Kobayashi et al., Leukemia, 2025, CC BY 4.0(https://doi.org/10.1038/s41375-025-02729-w)を改変
そこでMDSモデルマウス造血幹細胞由来の巨核球に対して分化・成熟化を促進する化合物の探索を実施しました。その結果、細胞サイズを増大させる可能性のある5つの化合物を同定しました。これらの中から、研究グループは「クリゾチニブ」に注目しました(図1)。クリゾチニブにはこれまで巨核球分化促進活性は報告されておらず、「ALK融合遺伝子陽性非小細胞肺がん」の治療薬として承認されており、ドラッグリポジショニング*7の可能性があるためです。
研究グループは、クリゾチニブが巨核球の成熟を促進するメカニズムを解明するため、クリゾチニブの既知の標的分子である ALK/ROS1/c-MET キナーゼ*8の阻害が巨核球成熟に関与しているかを検討しました。ALK阻害剤(アレクチニブ)、ALK/ROS1阻害剤(ロルラチニブ)、c-MET阻害剤(カプマチニブ)を用いて実験を行ったところ、これらの薬剤の単独投与でも併用投与でも巨核球の核倍数化(エンドマイトーシス*2)は誘導されませんでした。このことから、クリゾチニブは ALK/ROS1/c-MET 以外の分子を阻害することで巨核球成熟を促進していることが示唆されました。さらにキナーゼ結合能を失ったクリゾチニブの光学異性体*9を用いた実験では、巨核球の核倍数化が誘導されなかったことから、クリゾチニブは特定のキナーゼを阻害することで作用していることが示唆されました。以前の研究において特定されていたクリゾチニブが結合するキナーゼのうち、巨核球成熟化に関与する可能性のある分子として、PLK4(ポロ様キナーゼ4)、オーロラBキナーゼ、オーロラAキナーゼ、LIMK1/2(LIMキナーゼ1/2)に着目し、これらのキナーゼに対する選択的阻害剤を用いた実験の結果、オーロラBキナーゼ阻害剤(バラセルチブ)とオーロラAキナーゼ阻害剤(アリセルチブ)が巨核球成熟化を誘導することを明らかにしました。さらにオーロラAキナーゼの基質であるPLK1(ポロ様キナーゼ1)の選択的阻害剤(ボラセルチブとBI2536)も巨核球の核倍数化を誘導しました。培養細胞を用いた実験では、クリゾチニブがオーロラAキナーゼを阻害し、PLK1のリン酸化レベルを低下させることが確認されました。これらのデータから、クリゾチニブはオーロラBキナーゼとオーロラAキナーゼの両方を阻害し、オーロラAキナーゼ阻害によるPLK1活性の抑制を介して巨核球成熟化に寄与することが示されました。
巨核球前駆細胞は細胞質分裂(細胞増殖)とエンドマイトーシス(分化)がバランスをとりながら巨核球・血小板造血を行っています。研究グループは、血小板減少を示すMDS患者の巨核球前駆細胞では、エンドマイトーシスではなく細胞質分裂/細胞周期を促進していると仮説を立てました。この仮説を検証するため、血小板減少の表現型に焦点を当てたMDS患者の遺伝子発現解析を行いました。遺伝子セット濃縮解析(Gene Set Enrichment Analysis)により、血小板数の低いMDS患者の骨髄造血幹細胞では、健常ドナーと比較して、細胞周期進行、特に有糸分裂に関連する遺伝子セットが濃縮されていることが明らかになりました。実際に、クリゾチニブの作用に関連するAURKA(オーロラAキナーゼ遺伝子)、AURKB(オーロラBキナーゼ遺伝子)、PLK1(ポロ様キナーゼ1遺伝子)の発現レベルは健常ドナーよりも患者で高いことが確認されました。さらに階層的クラスタリング解析により、細胞増殖を制御するE2Fターゲット(AURKAやPLK1を含む)の発現プロファイルは、正常な血小板数の患者や健常ドナーよりも、血小板減少を伴うMDS患者のサブセットで観察される傾向があることが示されました。これらの知見は、MDS(特に芽球増加を伴わないタイプ*3)では、細胞周期プログラムの調節不全がエンドマイトーシスではなく細胞質分裂を促進し、その結果として血小板減少を引き起こす可能性を裏付けています。
(別添)図2 MDSでの巨核球分化障害とクリゾニチブの作用
MDS(特に芽球増加を伴わないタイプ)では、細胞周期プログラムの調節不全がエンドマイトーシスではなく細胞質分裂を促進し、その結果として血小板減少を引き起こす(左)一方、クリゾチニブはオーロラキナーゼの阻害を通じて細胞質分裂を抑制し、巨核球前駆細胞から巨核球への分化とその成熟を促進することで血小板産生を改善する(右)。出典:Kobayashi et al., Leukemia, 2025, CC BY 4.0(https://doi.org/10.1038/s41375-025-02729-w)
最後に研究グループはクリゾチニブがヒト患者細胞やマウス生体内でも巨核球分化・成熟化を促進し、血小板数を増加させるか検証しました。クリゾチニブは臨床サンプル由来細胞の巨核球核倍数性を増加させ、マウス細胞だけでなくヒト細胞にも作用することが確かめられました。MDSモデルマウスを用いた薬効評価では、クリゾチニブは白血球数や赤血球数を変化させることなく血小板数を改善しました。この血小板数増加には骨髄内巨核球の核倍数性とサイズの増加が伴っていました。さらにクリゾチニブは骨髄内に蓄積した巨核球前駆細胞プールを減少させました。これらの知見から、クリゾチニブ治療はオーロラキナーゼの阻害を通じて巨核球前駆細胞から巨核球への分化とその成熟を促進することで血小板産生を改善することが示されました(図2)。以上の結果からクリゾチニブがMDSにおける血小板減少症に対する治療薬として大きな可能性を持つことが示唆されました。
*1 : クリゾチニブ
クリゾチニブは、非小細胞肺がん治療薬として2011年に米国FDAで初めて承認された経口分子標的薬です。商品名はザーコリ(Xalkori)として知られています。主にALK(未分化リンパ腫キナーゼ)遺伝子の転座や変異、およびROS1遺伝子再構成を有する進行性非小細胞肺がんの治療に用いられます。ALKおよびROS1チロシンキナーゼを標的とし、これらのキナーゼ活性を阻害することでがん細胞の増殖を抑制します。
*2 : 巨核球
巨核球は、血小板のもととなる大型の造血細胞です。通常の細胞と異なり、巨核球は独特の成熟過程を経て血小板を産生します。この成熟過程では、核の倍数性増加と細胞サイズの著しい増大が特徴的です。巨核球の成熟において最も重要なのは「エンドマイトーシス」と呼ばれる特殊な細胞分裂過程です。通常の細胞分裂では、DNA複製後に細胞質分裂が起こりますが、巨核球ではDNA複製と核分裂は進行するものの、細胞質分裂が抑制されます。この結果、一つの巨核球内に複数のDNAセットが蓄積し、8N、16N、32N、あるいはそれ以上の核DNA量を持つようになります。これにより細胞サイズも増大し、豊富な細胞質成分が形成されます。その豊富な細胞質を小さな断片に分けて血小板が形成されます。
*3: 骨髄異形成症候群(myelodysplastic neoplasms, MDS)
骨髄異形成症候群(MDS)は、造血幹細胞に異常が生じる血液悪性疾患です。造血幹細胞とは、骨髄に存在し、赤血球、白血球、血小板など全ての血液細胞に分化する能力を持つ未熟な細胞です。MDSでは、この造血幹細胞に遺伝子変異が蓄積し、正常な血液細胞への分化・成熟が障害されます。その結果、血球減少(貧血、好中球減少、血小板減少)や形態異常を伴う無効造血が特徴的な症状として現れます。また、MDSの進行に伴い、芽球(blast)と呼ばれる未熟な前駆細胞が増加することがあります。芽球は正常造血においても存在する未分化な細胞ですが、MDSでは異常な芽球が蓄積し、その割合が骨髄細胞の5%以上になると芽球を伴うMDSと診断され、20%以上になると急性骨髄性白血病へ移行したと判断されます。MDSは高齢者に多く発症し、進行すると急性白血病へ移行するリスクがあるため、適切な診断と治療が重要です。
*4: 血小板輸血
血小板輸血とは、血小板減少症の患者に対して血小板を補充するための治療法です。主に、出血傾向のある重度の患者に実施されます。血小板輸血製剤は、健康なドナーから採取された全血から血小板成分を分離する方法等で製造されます。製剤は室温(20-24℃)で振盪保存され、保存期間は細菌汚染リスクの観点から通常4-5日間に制限されています。輸血には同種免疫(抗HLA抗体や抗血小板抗体の産生)による輸血不応状態、輸血関連感染症、発熱・蕁麻疹などの輸血反応、輸血関連急性肺障害などのリスクが伴います。特に頻回輸血が必要なMDS患者では、これらの合併症が治療上の大きな課題となります。
*5: MDS患者巨核球の臨床観察
骨髄異形成症候群患者の骨髄では、しばしば巨核球の形態異常が観察されます。通常の巨核球に比べて著しく小型化した微小巨核球(micromegakaryocyte)や、通常の巨核球成熟過程で見られる核分葉が適切に進行していない非分葉核を持つ巨核球(megakaryocyte with non-lobed nucleus)も特徴的で、核倍数性増加や細胞サイズの拡大が十分に起こっていないことが知られています。
*6: in vitro
in vitroは「試験管内で」という意味のラテン語で、生物学的プロセスや実験を生体外の人工的な環境(試験管、培養皿、フラスコなど)で行うことを指します。生体内(in vivo)での実験と対比され、制御された条件下で特定の生物学的機能を研究するために用いられます。
*7: ドラッグリポジショニング
ドラッグリポジショニングとは、既に特定の疾患に対して承認されている医薬品を別の疾患の治療に用いるための研究開発アプローチです。既存薬は既に安全性プロファイルが確立されているため、その新しい適応症を見出すことで、医薬品開発プロセスを短縮し、開発コストを削減できる利点があります。
*8: キナーゼ
キナーゼは、タンパク質やその他の分子にATPからリン酸基を転移する酵素群で、細胞内のシグナル伝達や代謝調節において重要な役割を担っています。リン酸化されたタンパク質は構造や機能を変化させ、細胞内の様々な生化学的プロセスを制御します。チロシンキナーゼやセリン/スレオニンキナーゼなど多様なタイプが存在し、がんをはじめとする多くの疾患の発症や進行に関与することから、重要な創薬標的となっています。
*9: 光学異性体
光学異性体とは、分子の構造が鏡像関係にある化合物のことです。これらは同一の化学式と結合様式を持ちますが、空間的な配置が異なり、互いに重ね合わせることができません。右手と左手の関係に似ており、このため「キラル(手性)」とも呼ばれます。クリゾチニブの場合、(R)-クリゾチニブと(S)-クリゾチニブの光学異性体が存在し、それぞれ異なる生物学的活性を示すため、医薬品開発において重要な概念となっています。
7. 研究支援
本研究は、日本学術振興会(JSPS)科学研究費助成事業 JP20K07840(原田結花、原田浩徳)、JP22H02905(原田浩徳、原田結花)、JP23K06899(原田結花、原田浩徳)、JP23H04882(吉田稔)、JP23H05473(吉田稔)、JP24K10365(小林大貴、原田浩徳)、MSD生命科学財団研究助成(小林大貴)、日本新薬公募研究助成(小林大貴)、都立病院臨床研究(R040301001、R050401011;原田結花)および日本血液学会研究助成(原田浩徳、原田結花)の支援を受けて実施されました。
8. 原著論文情報
Hiroki Kobayashi, Yuta Komizo, Nanami Watanabe, Yu Miyata, Yoshiya Ohnuma, Yasushige Kamimura-Aoyagi, Kanako Yuki, Yoshihiro Hayashi, Minoru Yoshida, Yuka Harada, and Hironori Harada, “Unraveling the impact of crizotinib to promote megakaryopoiesis for alleviating thrombocytopenia in myelodysplastic neoplasms”, Leukemia, https://doi.org/10.1038/s41375-025-02729-w
本件に関するお問い合わせ先
入試・広報センター
- 住所
- 東京都八王子市堀之内1432-1
- TEL
- 042-676-4921
- FAX
- 042-676-8961
- kouhouka@toyaku.ac.jp