【名古屋大学】従来mRNAに対し100倍以上の翻訳活性を示す完全化学合成mRNAを開発~精密な化学修飾導入が拓くmRNA医薬の分子設計~
【本研究のポイント】
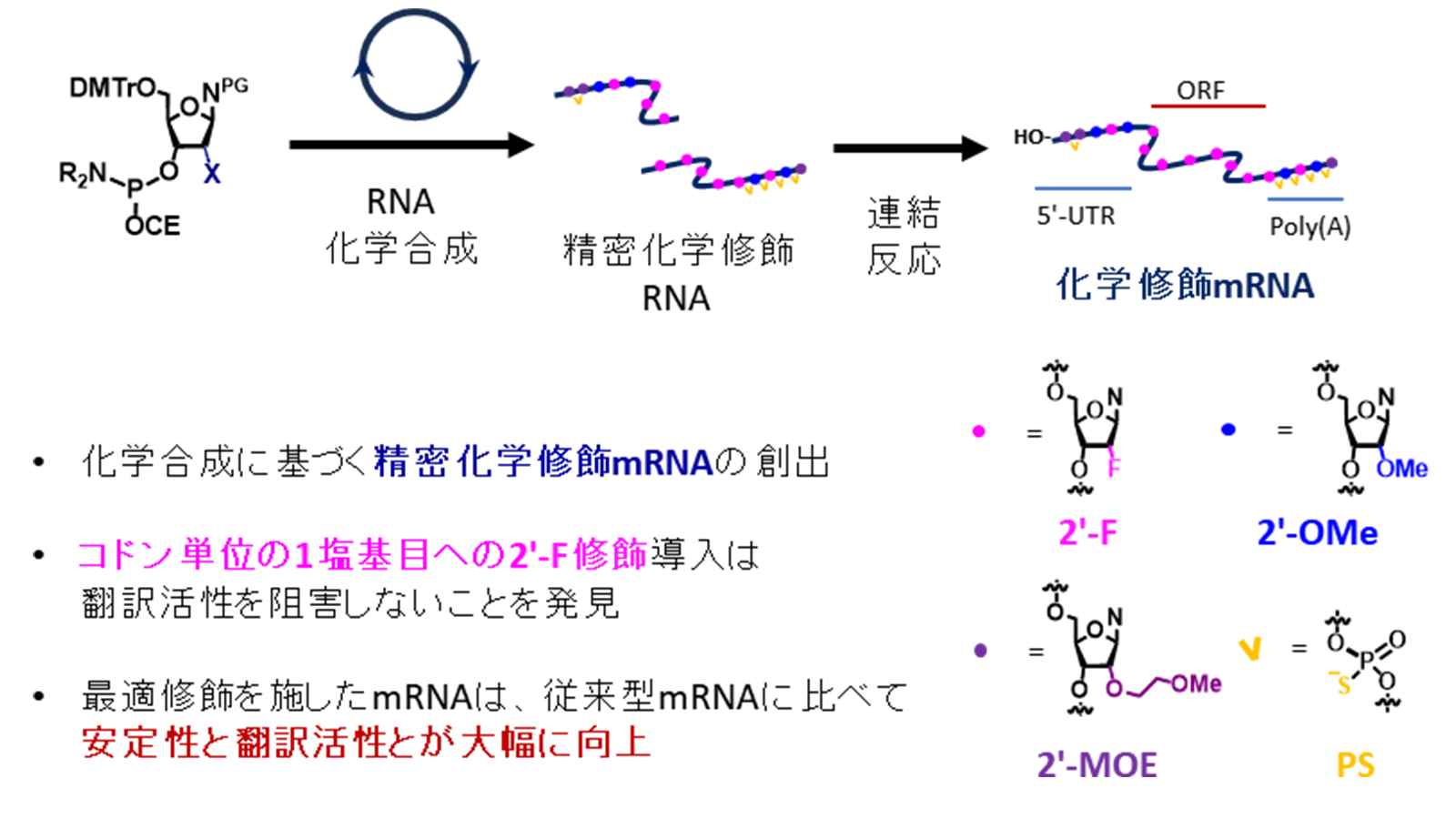
・キャップ構造注1)の有無によらず、効率的な翻訳を可能にする化学修飾mRNAを創出。
・コドン注2)1塩基目への選択的化学修飾により、翻訳活性を維持したまま安定性を飛躍的に向上させる設計指針を提示。
・完全化学合成を基盤とした精密化学修飾による高活性化という、mRNA医薬の応用範囲を大きく広げうる新規アプローチを提唱。
・キャップ構造注1)の有無によらず、効率的な翻訳を可能にする化学修飾mRNAを創出。
・コドン注2)1塩基目への選択的化学修飾により、翻訳活性を維持したまま安定性を飛躍的に向上させる設計指針を提示。
・完全化学合成を基盤とした精密化学修飾による高活性化という、mRNA医薬の応用範囲を大きく広げうる新規アプローチを提唱。
【研究概要】
名古屋大学大学院理学研究科の阿部 洋 教授、木村 康明 准教授らの研究グループは、協和キリン株式会社の山本 潤一郎 マネージャー、岩井 宏徒 主任研究員らとの共同研究で、次世代医薬として期待されるmRNA医薬の性能向上を目指し、化学合成技術を基盤とした新しい分子設計戦略を開発しました。mRNA医薬は生体内での不安定さや翻訳活性の低さが課題でした。本研究ではmRNAの特定の位置に化学修飾を精密に導入することでこれらの課題解決に取り組みました。特に、タンパク質をコードする領域(ORF注3))内の各コドンの1番目のリボ核酸(RNA)注4)に2′-フルオロ(2′-F)修飾注5)を施すことが、翻訳活性を損なうことなくmRNAの安定性を顕著に高めること、さらに5′-非翻訳領域(5′-UTR)注6)やポリAテール注7)への適切な化学修飾との組み合わせが、持続的かつ効率的な翻訳を可能にすることを発見しました。この化学修飾mRNAは細胞実験において、既存の酵素合成法で調製されたmRNAを大幅に上回る優れた翻訳活性と安定性を示しました。また、精密化学修飾されたmRNAは、キャップ非依存的な翻訳開始を起こすことを見出しました。本成果は、より効果的で安全なmRNA医薬の創出に貢献する重要な基盤技術となることが期待されます。
本研究成果は、2025年11月19日19時(日本時間)付 国際科学雑誌『Nature Communications』に掲載されました。
名古屋大学大学院理学研究科の阿部 洋 教授、木村 康明 准教授らの研究グループは、協和キリン株式会社の山本 潤一郎 マネージャー、岩井 宏徒 主任研究員らとの共同研究で、次世代医薬として期待されるmRNA医薬の性能向上を目指し、化学合成技術を基盤とした新しい分子設計戦略を開発しました。mRNA医薬は生体内での不安定さや翻訳活性の低さが課題でした。本研究ではmRNAの特定の位置に化学修飾を精密に導入することでこれらの課題解決に取り組みました。特に、タンパク質をコードする領域(ORF注3))内の各コドンの1番目のリボ核酸(RNA)注4)に2′-フルオロ(2′-F)修飾注5)を施すことが、翻訳活性を損なうことなくmRNAの安定性を顕著に高めること、さらに5′-非翻訳領域(5′-UTR)注6)やポリAテール注7)への適切な化学修飾との組み合わせが、持続的かつ効率的な翻訳を可能にすることを発見しました。この化学修飾mRNAは細胞実験において、既存の酵素合成法で調製されたmRNAを大幅に上回る優れた翻訳活性と安定性を示しました。また、精密化学修飾されたmRNAは、キャップ非依存的な翻訳開始を起こすことを見出しました。本成果は、より効果的で安全なmRNA医薬の創出に貢献する重要な基盤技術となることが期待されます。
本研究成果は、2025年11月19日19時(日本時間)付 国際科学雑誌『Nature Communications』に掲載されました。
【研究背景と内容】
mRNA(メッセンジャーRNA)医薬は、生体にmRNAを投与し、その情報を基に体内で予防用・治療用タンパク質を合成させるという作用機序を持つ医薬品です。新型コロナウイルスに対するワクチンでその有効性と迅速な開発可能性が実証され、現在、感染症予防のみならず、がん治療、遺伝性疾患治療、タンパク質補充療法など、多岐にわたる疾患領域での応用開発が活発に進められています。mRNA医薬は、従来の低分子医薬や抗体医薬では標的とすることが難しかったタンパク質を対象にできる点や、従来のタンパク質医薬と比べても、多様な医薬品候補を迅速に設計・製造できる点など、多くの利点を有しています。しかし、実用化に向けてはいくつかの重要な課題が存在します。その一つが、mRNA分子自体の不安定さです。生体内にはリボヌクレアーゼと呼ばれるRNA分解酵素が普遍的に存在し、投与されたmRNAは速やかに分解されてしまうため、治療効果が持続しにくいという問題があります。もう一つの課題は、タンパク質への翻訳活性です。mRNAからタンパク質が合成されるプロセスは複雑であり、必ずしも効率よく目的のタンパク質が産生されるわけではありません。これらの課題を克服し、より少ない投与量で、より長く、より多くのタンパク質を発現させることが、mRNA医薬の性能向上には不可欠です。
mRNA(メッセンジャーRNA)医薬は、生体にmRNAを投与し、その情報を基に体内で予防用・治療用タンパク質を合成させるという作用機序を持つ医薬品です。新型コロナウイルスに対するワクチンでその有効性と迅速な開発可能性が実証され、現在、感染症予防のみならず、がん治療、遺伝性疾患治療、タンパク質補充療法など、多岐にわたる疾患領域での応用開発が活発に進められています。mRNA医薬は、従来の低分子医薬や抗体医薬では標的とすることが難しかったタンパク質を対象にできる点や、従来のタンパク質医薬と比べても、多様な医薬品候補を迅速に設計・製造できる点など、多くの利点を有しています。しかし、実用化に向けてはいくつかの重要な課題が存在します。その一つが、mRNA分子自体の不安定さです。生体内にはリボヌクレアーゼと呼ばれるRNA分解酵素が普遍的に存在し、投与されたmRNAは速やかに分解されてしまうため、治療効果が持続しにくいという問題があります。もう一つの課題は、タンパク質への翻訳活性です。mRNAからタンパク質が合成されるプロセスは複雑であり、必ずしも効率よく目的のタンパク質が産生されるわけではありません。これらの課題を克服し、より少ない投与量で、より長く、より多くのタンパク質を発現させることが、mRNA医薬の性能向上には不可欠です。
これまで、これらの課題解決のためにさまざまなアプローチが試みられてきました。代表的なものとしては、mRNAを構成する塩基の一つであるウリジンを1-メチルシュードウリジン(m1Ψ)注8)などの修飾塩基に置き換えることで、免疫原性を低減しつつ翻訳活性を高める方法や、mRNAの5’末端に存在するキャップ構造注1)と呼ばれる部位に人工的な化学修飾を導入して分解を抑制すること、などが挙げられます。これらの技術はmRNA医薬の発展に大きく貢献しましたが、さらなる機能向上を目指すには、より多様な化学修飾をmRNA分子の適切な位置に導入し、その効果を精密に制御する技術が求められていました。特に、リボース(RNAを構成する糖)の2’位への化学修飾は、オリゴ核酸医薬(アンチセンス医薬やsiRNA医薬など)において核酸分解酵素に対する抵抗性を付与するために広く用いられていますが、mRNAのORF領域においては、導入する修飾の構造や位置によっては、リボソーム注9)の進行を妨げ、翻訳効率が著しく低下することが知られていました。本研究では、化学合成技術の利点を最大限に活かすことで、この課題に挑みました。酵素合成法では導入が難しい、あるいは不可能な位置特異的な化学修飾や新規の化学修飾を導入できる「完全化学合成プラットフォーム」を構築しました。このプラットフォームでは、まず短いRNA断片を化学的に合成し、その後、これらの断片を化学的連結反応によって繋ぎ合わせることで、目的とする精密化学修飾mRNAを調製します。
この技術を用いて、まず短いペプチドをコードした91塩基長のモデルmRNAを作製し、さまざまな化学修飾の翻訳活性への影響を、細胞抽出液を用いた無細胞翻訳系注10)で評価しました。特に注目したのは、ORF領域内のコドン単位での糖修飾パターンです。コドンは3つの塩基で構成されますが、その1番目、2番目、3番目の各リボ核酸の2’位に2′-F修飾を導入したmRNAをそれぞれ合成し比較したところ、1番目のリボ核酸への2′-F修飾のみが、翻訳活性の低下を最小限に抑えつつ、mRNAの安定性を向上させる可能性を示しました(図1A)。一方で、2番目や3番目のリボ核酸の全箇所に修飾を導入した場合は、翻訳活性が一定程度低下し、また、2′-OMe修飾注11)、2′-MOE修飾注11)といった他の糖部修飾を1番目の位置の全箇所に導入した場合は、翻訳活性が大きく低下しました。また同位置のDNAへの置換においては、翻訳活性の低下は中程度に留まりました。これは修飾核酸の種類と導入位置によって、リボソームの読み取りの許容性が大きく異なることを示唆しています。(図1B)
次に、この発見をより長いペプチドをコードするmRNA(145-165塩基長)で検証するとともに、mRNAの翻訳効率や安定性に重要な役割を果たす5′-UTRおよびポリAテールの化学修飾についても詳細な検討を行いました。その結果、5′-UTRやポリAテールに2′-OMe修飾や2′-MOE修飾などを導入することで、翻訳活性が向上することを確認しました。また、これらの修飾ポリAテールが、翻訳サイクルに重要なポリA結合タンパク質(PABP)との結合能を一定程度保持していることも確認しました。
これらの系統的な構造活性相関研究から得られた知見を組み合わせ、ORF領域のコドンの1塩基目に2′-F修飾を導入し、かつ5′-UTRとポリAテールに2′-OMe修飾やリン酸骨格のチオ化(ホスホロチオエート(PS)化)注12)を施した化学修飾mRNAを設計・合成しました。この化学修飾mRNAをHeLa細胞に導入し、mRNA安定性とタンパク質発現量を評価しました。その結果、未修飾のmRNAと比較して、化学修飾mRNAは細胞内での分解が著しく抑制され、その結果ペプチドの発現量が大幅に増加し、その効果は48時間以上持続しました。
さらに、このキャップ構造を持たない化学修飾mRNAの性能を、現在主流の、m1Ψ修飾を導入した転写合成mRNAと比較検討しました。マウス血清中での安定性評価では、化学修飾mRNAはm1Ψ修飾mRNAより顕著に高い安定性を示しました(図2)。HeLa細胞における翻訳活性評価においても、化学修飾mRNAは、m1Ψ修飾mRNAよりも高いタンパク質発現量を示しました。これは、化学修飾による高い安定性が、持続的なタンパク質供給に寄与していることを示唆しています。mRNAに化学修飾を導入することで得られる圧倒的な翻訳活性の向上は、モデルペプチドだけでなく、組織の修復や再生を促す効果を持つペプチドであるEGF(上皮成長因子)をコードしたmRNAにおいても確認されました。また化学修飾mRNAは、細胞への導入後も顕著な細胞毒性や炎症性サイトカイン注13)の産生誘導を示しませんでした。
これらの結果は、本研究で開発した化学修飾戦略が、既存の技術を大きく凌駕するポテンシャルを持つ新しいアプローチであることを強く示しています。
これらの系統的な構造活性相関研究から得られた知見を組み合わせ、ORF領域のコドンの1塩基目に2′-F修飾を導入し、かつ5′-UTRとポリAテールに2′-OMe修飾やリン酸骨格のチオ化(ホスホロチオエート(PS)化)注12)を施した化学修飾mRNAを設計・合成しました。この化学修飾mRNAをHeLa細胞に導入し、mRNA安定性とタンパク質発現量を評価しました。その結果、未修飾のmRNAと比較して、化学修飾mRNAは細胞内での分解が著しく抑制され、その結果ペプチドの発現量が大幅に増加し、その効果は48時間以上持続しました。
さらに、このキャップ構造を持たない化学修飾mRNAの性能を、現在主流の、m1Ψ修飾を導入した転写合成mRNAと比較検討しました。マウス血清中での安定性評価では、化学修飾mRNAはm1Ψ修飾mRNAより顕著に高い安定性を示しました(図2)。HeLa細胞における翻訳活性評価においても、化学修飾mRNAは、m1Ψ修飾mRNAよりも高いタンパク質発現量を示しました。これは、化学修飾による高い安定性が、持続的なタンパク質供給に寄与していることを示唆しています。mRNAに化学修飾を導入することで得られる圧倒的な翻訳活性の向上は、モデルペプチドだけでなく、組織の修復や再生を促す効果を持つペプチドであるEGF(上皮成長因子)をコードしたmRNAにおいても確認されました。また化学修飾mRNAは、細胞への導入後も顕著な細胞毒性や炎症性サイトカイン注13)の産生誘導を示しませんでした。
これらの結果は、本研究で開発した化学修飾戦略が、既存の技術を大きく凌駕するポテンシャルを持つ新しいアプローチであることを強く示しています。
【成果の意義】
本研究は、化学合成技術を駆使した精密な化学修飾導入により、mRNA医薬の性能を大幅に向上させる新しい分子設計戦略を提示した点で、学術的にも産業的にも大きな意義を持ちます。
第一に、mRNAの安定性と翻訳効率という、これまで両立が難しかった課題に対し、「ORF内コドンの1番目のリボ核酸への2′-F修飾」、および「5′-UTRやポリAテールといったmRNA末端のリボ核酸の化学修飾」という特異的かつ効果的な解決策を具体的に示しました。これは、mRNA医薬の作用持続時間の延長や投与量の低減につながる可能性があります。
第二に、「完全化学合成による位置特異的修飾mRNA作製技術」は、これまでの酵素合成法では不可能だった自由度の高い分子設計を可能にする革新的なプラットフォームです。これにより、mRNAの機能をさらに精密に制御したり、新たな機能を付与したりする研究が加速され、mRNA医薬の応用範囲が格段に広がることが期待されます。
第三に、本研究で得られた化学修飾mRNAは、その高く持続的な活性により、mRNA医薬の分野において、転写合成mRNAでは達成が難しい新たな治療選択肢をもたらし得ます。例えば、個別化がんワクチン、タンパク質補充、組織再生などへの応用が考えられます。
本研究は、2021年度から始まった日本医療研究開発機構(AMED)の 革新的先端研究開発支援事業インキュベートタイプ(LEAP)事業「化学を基盤としたmRNAの分子設計・製造法の革新とワクチンへの展開」の支援のもとで行われたものです。
本研究は、化学合成技術を駆使した精密な化学修飾導入により、mRNA医薬の性能を大幅に向上させる新しい分子設計戦略を提示した点で、学術的にも産業的にも大きな意義を持ちます。
第一に、mRNAの安定性と翻訳効率という、これまで両立が難しかった課題に対し、「ORF内コドンの1番目のリボ核酸への2′-F修飾」、および「5′-UTRやポリAテールといったmRNA末端のリボ核酸の化学修飾」という特異的かつ効果的な解決策を具体的に示しました。これは、mRNA医薬の作用持続時間の延長や投与量の低減につながる可能性があります。
第二に、「完全化学合成による位置特異的修飾mRNA作製技術」は、これまでの酵素合成法では不可能だった自由度の高い分子設計を可能にする革新的なプラットフォームです。これにより、mRNAの機能をさらに精密に制御したり、新たな機能を付与したりする研究が加速され、mRNA医薬の応用範囲が格段に広がることが期待されます。
第三に、本研究で得られた化学修飾mRNAは、その高く持続的な活性により、mRNA医薬の分野において、転写合成mRNAでは達成が難しい新たな治療選択肢をもたらし得ます。例えば、個別化がんワクチン、タンパク質補充、組織再生などへの応用が考えられます。
本研究は、2021年度から始まった日本医療研究開発機構(AMED)の 革新的先端研究開発支援事業インキュベートタイプ(LEAP)事業「化学を基盤としたmRNAの分子設計・製造法の革新とワクチンへの展開」の支援のもとで行われたものです。
【用語説明】
注1)キャップ構造:
mRNAの5’端につく特殊な化学構造で、分解から保護すると同時に翻訳の開始を助ける役割がある。
注2)コドン:
mRNA上でタンパク質を構成するアミノ酸を指定する3つの塩基の並び。
注3)ORF:
mRNA上で実際にタンパク質の配列を決める部分。Open Reading Frameの略語。
注4)リボ核酸(RNA):
DNA(デオキシリボ核酸)とともに遺伝情報を担う核酸の一種。糖部分がリボースであるもの。
注5)2′-フルオロ(2′-F)修飾:
リボースの2’位の水酸基がフッ素原子に置き換わった化学修飾。核酸分解酵素に対する抵抗性を高める効果がある。
注6)5′-非翻訳領域(5′-UTR):
mRNAの5’末端に位置し、タンパク質には翻訳されないが、翻訳効率の調節などに関わる領域。
注7)ポリAテール:
mRNAの3’末端に付加されるアデニン(A)が連続した配列。mRNAの安定化や翻訳効率の向上に関与する。
注8)1-メチルシュードウリジン(m1Ψ):
ウリジン塩基の異性体であるシュードウリジンがさらにメチル化されたもの。mRNAの免疫原性を低減し、翻訳効率を高める効果が知られている。
注9)リボソーム:
mRNA上の情報(コドン)を読み取り、アミノ酸を順に結合してタンパク質を作る細胞内の複合体。
注10)無細胞翻訳系:
細胞抽出液を用い、試験管内でタンパク質を合成させる実験系。
注11)2′-OMe修飾、2′-MOE修飾:
それぞれリボースの2’位の水酸基がメトキシ基、メトキシエチル基に置き換わった化学修飾。2′-F修飾と同様に核酸分解酵素への抵抗性を高める。
注12)ホスホロチオエート(PS)化:
核酸のリン酸ジエステル結合の一つの非架橋酸素原子が硫黄原子に置換された化学修飾。核酸分解酵素に対する抵抗性を大幅に向上させる。
注13)炎症性サイトカイン:
免疫細胞などが産生するシグナル性タンパク質で、炎症反応を引き起こす。
【論文情報】
雑誌名: Nature Communications
論文タイトル: Position-Specific ORF Nucleoside-Ribose Modifications Enabled by Complete Chemical Synthesis Enhance mRNA Stability and Translation
著者: 岩井宏徒(協和キリン株式会社)、木村康明*(名古屋大学)、本間正一(協和キリン株式会社)、中本航介(名古屋大学、研究当時)、橋本淳志(協和キリン株式会社)、本澤慶一(協和キリン株式会社)、愛宕孝之(協和キリン株式会社)、浅野奏(協和キリン株式会社)、橋谷文貴(名古屋大学)、阿部奈保子(名古屋大学)、小林敬子(協和キリン株式会社)、荻巣亮子(名古屋大学)、山田浩貴(協和キリン株式会社)、平石敬子(協和キリン株式会社)、斎藤誠嗣(協和キリン株式会社)、山本潤一郎*(協和キリン株式会社)、阿部洋*(名古屋大学) (*は責任著者)
DOI: https://doi.org/10.1038/s41467-025-65788-8
注1)キャップ構造:
mRNAの5’端につく特殊な化学構造で、分解から保護すると同時に翻訳の開始を助ける役割がある。
注2)コドン:
mRNA上でタンパク質を構成するアミノ酸を指定する3つの塩基の並び。
注3)ORF:
mRNA上で実際にタンパク質の配列を決める部分。Open Reading Frameの略語。
注4)リボ核酸(RNA):
DNA(デオキシリボ核酸)とともに遺伝情報を担う核酸の一種。糖部分がリボースであるもの。
注5)2′-フルオロ(2′-F)修飾:
リボースの2’位の水酸基がフッ素原子に置き換わった化学修飾。核酸分解酵素に対する抵抗性を高める効果がある。
注6)5′-非翻訳領域(5′-UTR):
mRNAの5’末端に位置し、タンパク質には翻訳されないが、翻訳効率の調節などに関わる領域。
注7)ポリAテール:
mRNAの3’末端に付加されるアデニン(A)が連続した配列。mRNAの安定化や翻訳効率の向上に関与する。
注8)1-メチルシュードウリジン(m1Ψ):
ウリジン塩基の異性体であるシュードウリジンがさらにメチル化されたもの。mRNAの免疫原性を低減し、翻訳効率を高める効果が知られている。
注9)リボソーム:
mRNA上の情報(コドン)を読み取り、アミノ酸を順に結合してタンパク質を作る細胞内の複合体。
注10)無細胞翻訳系:
細胞抽出液を用い、試験管内でタンパク質を合成させる実験系。
注11)2′-OMe修飾、2′-MOE修飾:
それぞれリボースの2’位の水酸基がメトキシ基、メトキシエチル基に置き換わった化学修飾。2′-F修飾と同様に核酸分解酵素への抵抗性を高める。
注12)ホスホロチオエート(PS)化:
核酸のリン酸ジエステル結合の一つの非架橋酸素原子が硫黄原子に置換された化学修飾。核酸分解酵素に対する抵抗性を大幅に向上させる。
注13)炎症性サイトカイン:
免疫細胞などが産生するシグナル性タンパク質で、炎症反応を引き起こす。
【論文情報】
雑誌名: Nature Communications
論文タイトル: Position-Specific ORF Nucleoside-Ribose Modifications Enabled by Complete Chemical Synthesis Enhance mRNA Stability and Translation
著者: 岩井宏徒(協和キリン株式会社)、木村康明*(名古屋大学)、本間正一(協和キリン株式会社)、中本航介(名古屋大学、研究当時)、橋本淳志(協和キリン株式会社)、本澤慶一(協和キリン株式会社)、愛宕孝之(協和キリン株式会社)、浅野奏(協和キリン株式会社)、橋谷文貴(名古屋大学)、阿部奈保子(名古屋大学)、小林敬子(協和キリン株式会社)、荻巣亮子(名古屋大学)、山田浩貴(協和キリン株式会社)、平石敬子(協和キリン株式会社)、斎藤誠嗣(協和キリン株式会社)、山本潤一郎*(協和キリン株式会社)、阿部洋*(名古屋大学) (*は責任著者)
DOI: https://doi.org/10.1038/s41467-025-65788-8
本件に関するお問い合わせ先
名古屋大学総務部広報課
- TEL
- 052-558-9735
- FAX
- 052-788-6272
- nu_research@t.mail.nagoya-u.ac.jp