【東京薬科大学】蛋白質アクチンの高分解能構造とATP加水分解反応メカニズムの解明 — 地球上の生命の最も重要な化学反応の一つの理解の前進 —
・蛋白質 アクチンのF型の高分解能構造を解明。
・それら構造を基に量子化学の計算法を使ってATP加水分解反応(注1)のメカニズムを解明。
・地球上の生命維持にとって最も重要な化学反応の一つであるATP加水分解反応の共通メカニズムの理解を大きく進めた。
国立大学法人東海国立大学機構 名古屋大学大学院理学研究科の前田 雄一郎 特任教授(研究当時。現在は、名古屋大学大学院情報学研究科客員教授)、国立大学法人広島大学大学院先進理工系科学研究科の兼松 佑典 助教、および国立大学法人岡山大学異分野基礎科学研究所の武田 修一 特任助教を中心とした研究チームは、蛋白質F型アクチンの1.15Å(オングストローム)分解能の結晶構造を得て、それに基づき量子化学計算法であるQM/MM計算法を用いて、ATP加水分解反応のメカニズムを解明しました。ATPは地球上の生命のエネルギー通貨です。ATPの化学エネルギーは、ATPアーゼ蛋白質(注2)と呼ばれる多くの蛋白質によって、力学的仕事や情報に変換され、種々の細胞機能の発現に利用されますが、蛋白質分子の構造情報の不足によりそのメカニズムはよくわかっていませんでした。本研究では、F型アクチン(注3)の構造を反応の始状態と終状態の双方で、他のいかなるATPアーゼ蛋白質で得られていた構造情報より高精細な1.15Åという高分解能で得て、この問題を解決しました。解明されたATP加水分解反応メカニズム は、これまで提案されていた反応モデルと基本的に一致し、地球上のATPアーゼ蛋白質が共通のメカニズムで働くことを強く示唆します。
今回解明されたのはATPアーゼ過程(注4)全体の前半部分(加水分解反応過程)のみであり、後半部分(Pi解離過程)は、未解明です。今後はPi解離過程の研究が進むことが期待されます。
本研究成果は、2022年10月18日付アメリカ科学雑誌「米国科学アカデミー紀要(PNAS)」のオンライン速報版に掲載されました。
[1]ATPアーゼ蛋白質、ATPアーゼ全過程およびATP加水分解反応
ATP(アデノシン3リン酸)は地球上の生物の細胞内でエネルギー通貨として使われます。すなわち、ATPアーゼという一群の蛋白質が、蛋白質内部にATPを結合して、必要なときにADP(アデノシン2リン酸)とPi(無機リン酸)に加水分解することによって(図3)ATPの化学的エネルギーを力学的仕事や情報に変換します。この全過程をATPアーゼ過程と呼びます。
蛋白質内部での化学反応のメカニズムをどのように解明するのでしょうか?現在の科学では、実験的にそれを明らかにする方法はありませんので、2つの方法を組み合わせます。第一は、反応の始状態と反応の終状態のそれぞれの正確な構造(水分子を含めた原子の位置)を実験的に得ます。第二は、その2つの構造を結ぶ最も蓋然性の高い反応経路を、計算機を使ってQM/MM法(注5)という計算法で求めます。
ATP加水分解反応メカニズム の解明が遅れていた理由は、第一の高精細の構造情報が揃ったATPアーゼ蛋白質が無かったためです。そのような制約があるなかでも、F1-ATPase(※1)、kinesin(※2)、myosin(※3)の3つのモーター蛋白質のATP加水分解反応の反応過程がQM/MM法を使って解明がなされており、それなりに説得力のある結果が発表されていました。しかし、それらの解析も、それぞれ欠陥があり、不完全さを残していました。主な理由は、やはり、始状態と終状態の高精細の構造情報が揃っていなかった点にありました。
(※1) Hayashi, S., H. Ueno, A. R. Shaikh, M. Umemura, M. Kamiya, Y. Ito, M. Ikeguchi, Y. Komoriya, R. Iino and H. Noji (2012). ”Molecular mechanism of ATP hydrolysis in F1-ATPase revealed by molecular simulations and single-molecule observations.” J Am Chem Soc 134(20): 8447-8454.
(※2) McGrath, M. J., I. F. Kuo, S. Hayashi and S. Takada (2013). ”Adenosine triphosphate hydrolysis mechanism in kinesin studied by combined quantum-mechanical/molecular-mechanical metadynamics simulations.” J Am Chem Soc 135(24): 8908-8919.
(※3) Kiani, F. A. and S. Fischer (2014). ”Catalytic strategy used by the myosin motor to hydrolyze ATP.” Proc Natl Acad Sci U S A 111(29): E2947-2956.
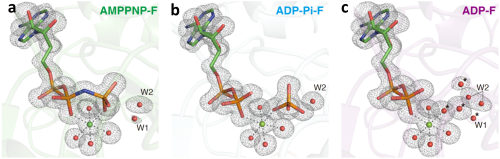
F型アクチンのATP加水分解反応メカニズムの解明を可能にした要因は、始状態のATP結合型と、終状態のADP-Pi結合型の蛋白質(アクチン)の構造(捕捉された水分子を含む)が1.15Å分解能という高分解能で揃って得られたことです(図1)。地球上の生物が持つ多くの種類のATPアーゼ蛋白質の構造が調べられていますが、反応前後の構造を共にこの高い分解能で得たのはF型アクチンが初めてです。その両者を用いて計算した反応のエネルギー・プロファイル(図2)は互いに一致し、実験(構造)と理論(反応経路)がよく辻褄が合い、蓋然性の高いものであることを示しました。
ATP加水分解反応については、水分子とATPとの間の結合生成が先行する「結合先行メカニズム(associative path)」か、ATP分子内の結合切断が先行する「切断先行メカニズム(dissociative path)」かという議論が古くから存在します。かつては前者を支持する教科書が多く見受けられました。ところがF型アクチンの加水分解反応過程を上記3つのモーター蛋白質の反応過程と比較したところ、反応の活性中心の構造は大きく異なるにもかかわらず、いずれの反応様式も基本的に共通で「切断先行メカニズム」に近いことが分かりました。すなわち、私たちの研究は、単にモーター蛋白質ATPアーゼの先行研究の結果を確認し支持するだけではなく、モーター蛋白質であるか否かによらずこの反応様式がATPアーゼ蛋白質の真の共通様式であることを強く示唆することになりました。
本研究で解明したF型アクチンのATP加水分解反応のメカニズムは、これまでのアクチンの生化学研究で解明されていた数々の特性を説明するのみならず、今後取り組まれるであろう蛋白質アクチンの細胞内での働きを解明するときの基礎になるものです。
蛋白質アクチンは、すべての真核生物の細胞に含まれ、しかも最も大量に存在する蛋白質です。研究の歴史では筋肉を構成する主要な蛋白質として発見されましたが、その後、筋肉以外の細胞にも含まれ、細胞運動、細胞内と細胞外の間のモノの輸送、細胞分裂、神経細胞の突起の伸長、脳・海馬での記憶の保持など多種多様な細胞機能を担っていることが分かってきました。新型コロナウイルスが感染して細胞に取り込まれるときにも(細胞のエンドサイトーシスという機能)、また増殖したウイルスが細胞外に出て行くときにも(細胞のエキソサイトーシスという機能)、感染された細胞のアクチンが動員されます。
アクチンは単量体と重合体の2つの状態で存在し、その間を循環する分子運動に依って細胞機能を担います。この循環的分子運動こそアクチンのATPアーゼ活性によってエネルギーを供給されています。
アクチンは単量体であるときの分子の形状(G型)と、重合体に組み込まれたときの分子の形状(F型)で異なります(図4)。F型アクチンのみがATPアーゼ活性を持ち、G型アクチンはATPを加水分解しません(図5)。よって、ATPアーゼ活性のメカニズムを解明するにはF型を研究する必要があるのですが、F型は普通、重合体としてのみ存在するため、重合体の構造を高分解能で解明しなくてはならない、しかしこれは困難と考えられてきました(※4)。私たちは、アクチン結合蛋白質フラグミンの部分(ドメイン1)(これをF1蛋白質と呼びます)は、アクチン分子と結合して1:1複合体(F1A複合体)を形成すると、アクチンをF型に捕捉することを発見しました(図6)(※5) 。そして、このF型アクチンは重合体を構成するF型アクチンとほぼ同一の特性を持つことを確認しました。すなわち、F1A複合体中のアクチンは、重合体アクチンの一分子モデルです。アクチン重合体に代わってF1A複合体を研究試料として使うことによって、ATP結合型、ADP-Pi結合型、ADP結合型のF型アクチン分子の高分解能構造をX線結晶構造解析の方法で得ることができました。
(※4) 最近、ドイツと米国の研究グループから、クライオ電子顕微鏡による重合体アクチンの構造解析の結果が2.2Å分解能で報告されようとしています。この構造情報は、蛋白質内部に捕捉された水分子の多くを可視化することに成功していますが、水分子の位置や存在確率など情報の質は、QM/MM計算に用いるには難があります。
(※5) 単量体のアクチン分子に種々の別な蛋白質分子、ないしはキノコ毒・海綿毒など小分子が結合した複合体の結晶構造は260以上報告されています。しかしそれらアクチン分子の形状がF型であったものは一つもありませんでした。私たちのF1A複合体で初めてF型の結晶構造が得られました。
本研究の成果は、すぐに社会・経済活動に役に立つものではありません。しかし、本研究の成果は、地球上のすべての生命活動にとって最重要な化学反応のメカニズムの理解にかかわることですので、必ず広範囲の生命科学、医学、薬学の諸分野の研究に影響を与えます。
蛋白質はそれぞれ個性的ですので、蛋白質の研究者は、常に狭い範囲の蛋白質を専門に研究しています。しかし、蛋白質内部での化学反応となると個々の蛋白質を超えて物理・化学の問題になり、これは蛋白質共通となります。蛋白質共通ですので、一つの蛋白質での結果が、すぐに広範囲の蛋白質の研究に直接影響することになります。
本論文は15名の共同執筆となりました。本研究は、蛋白質分子の結晶を調製してX線結晶構造解析法を使用しての構造生物学的研究と、収集した構造情報を基にしての量子化学計算の2本柱を中心としながら、その他、生化学、熱測定、分子動力学計算、など多くの分野の専門家の協力によって可能となりました。5年間におよぶ共同研究は、問題意識を共有しての粘り強い協同作業が必要となります。このような共同研究での研究者間のコミュニケーションはon-lineで代用できるものではなく、外出制限時を除いて数か月に一回、名古屋大学に集まっての長時間にわたる議論が必要でした。
本研究で特筆すべきことは、F型アクチンの結晶構造(1.15Å分解能)はすべて「あいちシンクロトロン光センター」(公益財団法人科学技術交流財団の運用)からの放射X線を用いて計測したことです。「あいちシンクロトン光センター」は蓄積電子エネルギー1.2GeVの小さな電子蓄積リングですが、故渡邉信久博士の設計による優れた特性を持つ単結晶測定用ビームライン(BL2S1)が稼働し、国際的にも最高のATPアーゼ蛋白質からの構造データを収集することができました。
本研究は、日本学術振興会・科学研究費補助金(科研費)、日本医療研究開発機構(AMED)、豊田理化学研究所、武田科学振興財団、大幸財団、アクチン研究会の支援のもとで行われたものです。
(注1) 「ATP加水分解反応」については、【研究の背景と成果の内容】 [1] 節を参照されたい。
(注2) 「ATPアーゼ蛋白質」については、【研究の背景と成果の内容】 [1] 節を参照されたい。
(注3) 「F型アクチン」については、【研究の背景と成果の内容】 [3] 節を参照されたい。
(注4) 「ATPアーゼ過程」 については、【研究の背景と成果の内容】 [1] 節を参照されたい。
(注5) QM/MM法:この計算方法は、化学反応に直接関与する原子は量子力学 (QM) で、そうでない他の原子は古典力学 (MM) で扱うハイブリッド計算法で、1976年にWarshelとLevittが考案した。この方法は正しく使えば効率的で正確であるため、2013年にはノーベル化学賞受賞の対象となった。
雑誌名:Proceedings of the National Academy of Sciences of the USA (米国科学アカデミー紀要)
論文タイトル:”Structures and Mechanisms of the actin ATP hydrolysis”
著者:
前田 雄一郎(まえだ・ゆういちろう)名古屋大学大学院・情報学研究科、客員教授
兼松 佑典(かねまつ・ゆうすけ)広島大学・大学院先進理工系科学研究科、助教
武田 修一(たけだ・しゅういち)岡山大学異分野基礎科学研究所、特任助教
成田哲博(なりた・あきひろ)名古屋大学大学院・理学研究科・生命理学専攻、准教授
小田俊郎(おだ・としろう) 東海学院大学・健康福祉学部・総合福祉学科、教授
小池亮太郎(こいけ・りょうたろう)名古屋大学大学院・情報学研究科・複雑系科学専攻、助教
太田元規(おおた・もとのり)名古屋大学大学院・情報学研究科・複雑系科学専攻、教授
鷹野優(たかの・ゆう)広島市立大学大学院・情報科学研究科・医用情報科学専攻、教授
森次圭(もりつぐ・けい)横浜市立大学・生命医科学研究科、特任准教授
藤原郁子(ふじわら・いくこ)長岡技術科学大学・技学研究院・物質生物系、准教授
田中康太郎(たなか・こうたろう)名古屋大学大学院・細胞生理学研究センター・構造生理学分野、助教
小松英幸(こまつ・ひでゆき)九州工業大学・大学院情報工学研究院 ・生命化学情報工学研究系、准教授
永江峰幸(ながえ・たかゆき)東京薬科大学・薬学部・医療衛生薬学科、助教
故渡邉信久(わたなべ・のぶひさ)名古屋大学・シンクロトロン光研究センター、教授 (2019.3.26没)
岩佐充貞(いわさ・みつさだ)名古屋大学大学院・情報学研究科・複雑系科学専攻、協力研究員
DOI: 10.1073/pnas.2122641119
URL: https://www.pnas.org/doi/10.1073/pnas.2122641119
東海国立大学機構 名古屋大学大学院情報学研究科
客員教授 前田 雄一郎(まえだ ゆういちろう)
TEL:090-1912-2973, 052-789-2585 FAX:052-747-6473
E-mail:ymaeda@cc.nagoya-u.ac.jp
広島大学大学院先進理工系科学研究科
助教 兼松 佑典(かねまつ ゆうすけ)
TEL/FAX:082-424-7726
E-mail:ykanem@hiroshima-u.ac.jp
岡山大学異分野基礎科学研究所
特任助教 武田 修一(たけだ しゅういち)
TEL/FAX:086-251-7820
E-mail:takedashuichi@okayama-u.ac.jp
東海国立大学機構 名古屋大学広報室
TEL:052-789-3058 FAX:052-789-2019
E-mail:nu_research@adm.nagoya-u.ac.jp
広島大学 広報室
TEL:082-424-3749 FAX:082-424-6040
E-mail:koho@office.hiroshima-u.ac.jp
岡山大学総務・企画部広報課
TEL:086-251-7292 FAX:086-251-7294
E-mail:www-adm@adm.okayama-u.ac.jp
東海学院大学入試広報部
TEL:058-389-2200 FAX:058-389-2205
E-mail:nyushi@tokaigakuin-u.ac.jp
広島市立大学 企画室
TEL:082-830-1666 FAX:082-836-1656
E-mail:kikaku@m.hiroshima-cu.ac.jp
横浜市立大学 総務部広報課
TEL:045-787-2414 FAX:045-787-2048
E-mail:koho@yokohama-cu.ac.jp
長岡技術科学大学 大学戦略課企画・広報室
TEL:0258-47-9209 FAX:0258-47-9010
E-mail:skoho@jcom.nagaokaut.ac.jp
九州工業大学広報課
TEL:093-884-3008 FAX:093-884-3533
E-mail:pr-kouhou@jimu.kyutech.ac.jp
東京薬科大学 総務部 広報課
TEL:042-676-6711 FAX:042-674-1633
E-mail:kouhouka@toyaku.ac.jp
公益財団法人科学技術交流財団・あいちシンクロトロン光センター
TEL:0561-76-8331 FAX:0561-21-1652
E-mail:aichisr@aichisr.jp
公益財団法人豊田理化学研究所
TEL:0561-63-6141 FAX:0561-63-6327
E-mail:riken@toyotariken.jp
本件に関するお問い合わせ先
総務部 広報課
- 住所
- 東京都八王子市堀之内1432-1
- TEL
- 0426766711
- FAX
- 042-676-1633
- kouhouka@toyaku.ac.jp