【東京医科大学】第二世代CAR-T細胞の抗腫瘍効果分子メカニズムを解明〜CAR-T細胞の機能的な違いと治療法選択の理解に期待〜
●CAR-T細胞はシグナルユニット「CARマイクロクラスター」を形成し殺腫瘍効果を発揮することが示されました。
●第二世代CD28ζ.CARに組み込まれているCD28は、マイクロクラスターを介してNF-κB経路という独自の活性化信号を増強しました。
●第二世代CD28ζ.CARの細胞表面にもCD28が発現しており、CD28マイクロクラスターを介してさらにNF-κB経路活性化信号が増強されました。
●CD28によって活性化信号が増強したことで、第二世代CD28ζ.CAR-T細胞がより腫瘍に浸潤し増殖を抑えることが、担癌マウスモデルを用いた実験から明らかになりました。
【研究の背景】
免疫チェックポイント阻害(immune checkpoint blockade : ICB)療法の登場により、これまでのがん治療の選択肢が劇的に広がりました。同時に、キメラ抗原受容体(chimeric antigen receptor : CAR)-T細胞療法や二重特異性抗体療法など、他のがん免疫療法も飛躍的に進歩しています。免疫細胞の中でも、直接腫瘍細胞に接着して殺すことができるリンパ球:T細胞は、どのがん免疫療法でも主役となっています。
CAR-T細胞療法は、患者さんから採取したリンパ球を増幅して戻す「養子免疫療法」の進化形です。腫瘍抗原を認識する外側の抗体部分と、T細胞の中に腫瘍の情報を伝える細胞内の部分との、コンバインした受容体CARを、患者さんから採取したT細胞に遺伝子導入し、それを患者さんに戻します。(養子に出され)戻されたCAR-T細胞は、患者さんの体内で、腫瘍細胞を認識し、直接殺します。
最初に開発されたCARは第一世代と呼ばれ、細胞内にT細胞受容体(T cell receptor : TCR)/CD3複合体の細胞内領域(CD3ζ鎖)のみが使われました(図2左)。しかしTCR/CD3からのみの信号(これを「1stシグナル」といいます)が単独で入ると、T細胞は細胞死を起こしてしまいます。これを回避するため、CD28や4-1BBなどの共刺激受容体をCD3ζ鎖に直列(リニア)に繋いだCARが開発され、第二世代のCARとして現在の治療法の大部分を占めています。共刺激受容体からの信号(「2ndシグナル」といいます)が、第二世代のCAR-T細胞を細胞死から守り、より強力な殺腫瘍効果を誘導します(図2右)。
現在、日本で承認されているCARには、B細胞性白血病/リンパ腫の抗原となるCD19を標的としたチサゲンレクルユーセル(キムリア®)、リソカブタゲンマラルユーセル(ブレヤンジ®)、アキシカブタゲンシロルユーセル(イエスカルタ®)や、B細胞成熟抗原(B-cell maturation antigen : BCMA)を標的としたシルタカブタゲンオートルユーセル(カービクティ®)、イデカブタゲンビクルユーセル(アベクマ®)があります。一方で、各種CARにも寛解後の再発の可能性や、固形腫瘍に対して有効性が限られるなど、課題も残されています。より優れた殺腫瘍効果を得るための工夫として、他の共刺激分子の選択も重要な要素であり、新たなCARのデザインとして研究されています。
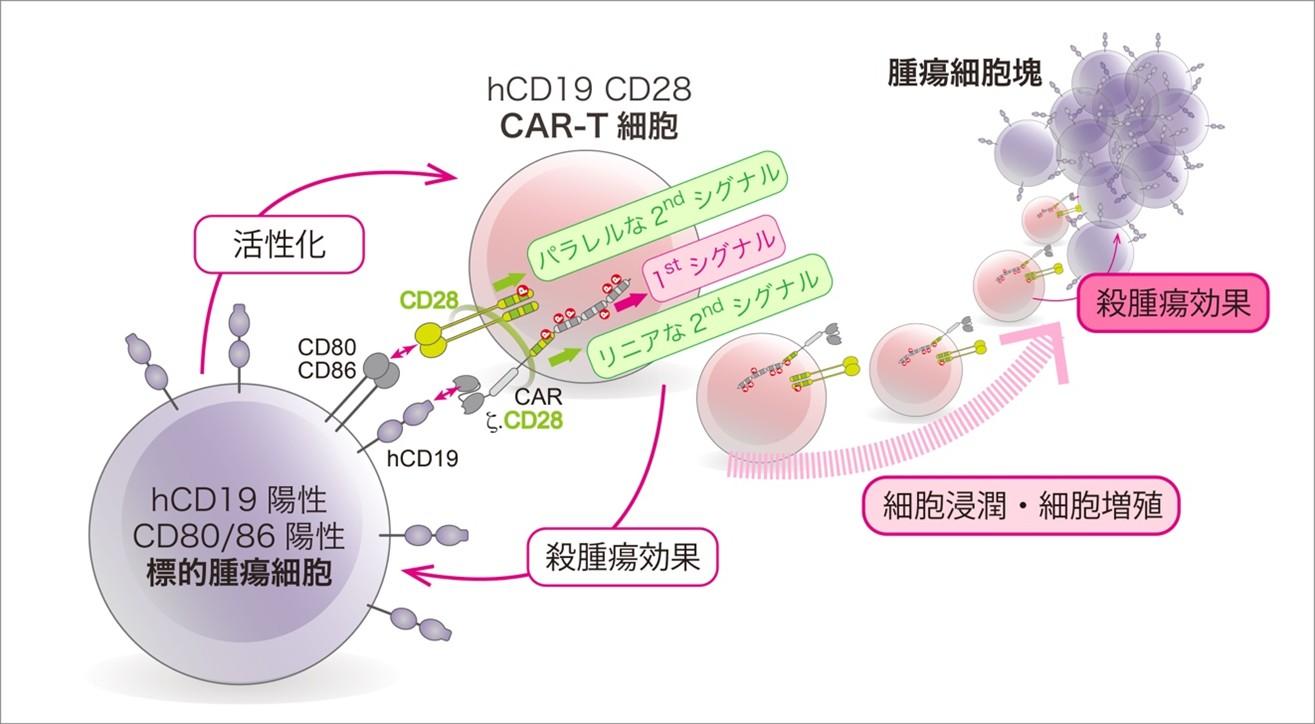
今回協同研究チームでは、CAR-T細胞自身にも内在性のCD28が発現していることに注目し、そこから発信される「パラレル(並列的)」な2ndシグナルと、第二世代CD28ζ.CARから直接発信されるの「リニア(直列的)」な2ndシグナルによって制御されるCAR-T細胞の殺腫瘍効果の違いを検討しました(図2)。
実験は、独自で開発した超解像顕微鏡システムを用い、CAR-T細胞を1細胞ずつ1分子レベルで画像化ができるイメージング法で行いました。T細胞は標的とする腫瘍細胞を見つけると接着し、「免疫シナプス」と呼ばれる細胞-細胞接着面を作ります。免疫シナプスには、腫瘍抗原を認識したTCR数十個集がまった「TCRマイクロクラスター」が200〜300個形成され、腫瘍抗原の認識と腫瘍細胞の殺傷を行う活性化ユニットとして機能します。つまりTCRマイクロクラスターがT細胞の機能を決定しているわけです。この微小な構造をより詳細に解析するため、協同研究チームでは、腫瘍細胞の細胞膜を模倣した支持脂質二重膜(Glass-supproted lipid bilayer : SLB)と1細胞1分子観察が可能な超解像顕微鏡を用いた高度な分子イメージング技術を用いました(Yokosuka et al., Nature Immunology, 2005)(図3)。
まず、腫瘍抗原を認識できるT細胞と腫瘍細胞を用いて、細胞-細胞接着面に集まるシグナル伝達分子を観察しました。CD28下流の代表的なシグナル伝達系として、①グルコース受容体などでも重要なPI3K-Akt-mTOR経路と、②がん化などに関わる活性化シグナルPKCθ-NF-κB経路が知られています。CD28を発現するT細胞とCD80を発現する腫瘍細胞を接着させると、それら細胞-細胞接着面にはPI3Kの触媒ユニット:p110δではなく(図4A右)、NF-κB経路の上流に位置する非典型プロテインキナーゼPKCθが顕著に集積しました(図4A左)。より詳細な分子の挙動を観察するため、SLBを腫瘍細胞の疑似膜として用い、T細胞-SLBの接着面を観察すると、PKCθ(緑)はTCR(赤)-CD28(水色)マイクロクラスターと重なることがわかりました(図4B左)。接着後20分を経過しても、TCRとCD28とPKCθは免疫シナプスの中心部に残り、この現象は2ndシグナルとしてのNF-κB経路の「持続」を意味しています(Yokosuka et al., Immunity, 2008)(図4B右)。
次に、B細胞性腫瘍を標的とした、抗hCD19抗体の抗原結合部位にCD28とCD3ζ鎖の細胞内領域を連結させたhCD19-CD28ζ.CARをT細胞に遺伝子導入し、hCD19を発現させたSLBとの接着面でのCARの挙動を観察しました。CARはhCD19との接着により、SLBとの接着面上でCARマイクロクラスターを形成しました(図5A)。hCD19-CD28ζ.CAR-T細胞は、SLBとの接着面を広げながら拡大し、その接着面にはhCD19-CD28ζ.CARの凝集塊「CARマイクロクラスター」が次々に形成され、60秒後に最大限に広がるとCARマイクロクラスターは求心性の移動を始め、免疫シナプスの中心部に集積しました(図5A)。さらに、細胞内領域にCD3ζ鎖のみを用いた第一世代のζ.CAR、そして第二世代のCARでもCD28の代わりに別の共刺激受容体4-1BBを用いた4-1BBζ.CARでも、マイクロクラスターの形成と挙動は同等でしたが、PKCθはCD28ζ.CARのみに集まり、CD28下流のシグナル伝達分子としての特異性が示されました (図5B,C)。この結果は、CARから直接的な2ndシグナル、つまり「リニア」な2ndシグナルが伝わったことを示します(図2C)。
次に、CAR-T細胞に発現しているT細胞内在性のCD28が、リガンドであるCD80/CD86と結合したときの「パラレル」な2ndシグナルの動きを、CARと並行して観察しました。SLB上にCD80が存在しない場合、hCD19との結合によるCAR(赤)のマイクロクラスターは可視化できますが、CD80が存在するとCD28(緑)も凝集し、CARマイクロクラスターと重なり黄色になります(図6)。この結果は、CARの1stシグナルと、CD28の「リニア」な2ndシグナルが融合していることを示唆しています。
次に、CD28下流で働く活性化分子PKCθ(緑)を指標に、CAR(赤)およびCD28から2ndシグナルが惹起されているかを検証しました。hCD19-ζ.CARが腫瘍抗原hCD19との結合により形成されるクラスターにはPKCθの信号は検出されませんが(図7A 上段)、SLB上にCD80がありCD28がクラスター化する条件では(図6 2段目)、PKCθの信号が検出されています(図7A 2段目)。これはCAR-T細胞にもともと発現している内在性のCD28からの「パラレル」な2ndシグナルと考えられます。一方、hCD19-CD28ζ.CARマイクロクラスターには、CD28-CD80結合がない条件下でもPKCθの信号が検出され(図7A 3段目)、CARに組み込まれたCD28からの「リニア」な2ndシグナルが惹起されていること、さらにCD28-CD80結合の存在下では、PKCθの信号は増強し(図7A 下段)、「リニア」+「パラレル」のダブルの2ndシグナルとして増強することが観察されました(図7A グラフ)。これら2ndシグナルがCAR-T細胞の機能にどのように寄与するかを検証するため、まず、in vitro(試験管内)でhCD19陽性細胞に対する殺腫瘍効果を調べましたが、ζ.CAR-T細胞とCD28ζ.CAR-T細胞、およびhCD19標的腫瘍細胞のCD80発現の有無での違いはありませんでした (図7B)。つまり、hCD19-ζ.CAR-T細胞もhCD19-CD28ζ.CAR-T細胞も、1つ1つの細胞の殺腫瘍効果は同じ、ということです。しかし、同じ条件下において、活性化の指標となるサイトカイン産生を測定すると、2ndシグナルの強弱とサイトカイン産生能とが相関することが分かりました(図7C)。
そこで協同研究チームは、in vivo(生体内)における長期的な腫瘍抑制にCD28からの2ndシグナルが重要性か、腫瘍移植マウスモデルを用いて検討しました。CAR-T細胞を移入した後の腫瘍の体積は、CD80を発現した腫瘍でより縮小し(図8A黒〇と●、赤〇と●との比較)、また、CD28ζ.CAR-T細胞移入群ではζ.CAR-T細胞移入群よりも腫瘍体積が小さくなっていました(図8A黒〇と赤〇との比較)。さらにCD80が発現している腫瘍とCD28ζ.CAR-T細胞移入との組み合わせは、より腫瘍の縮小が観察されました(図8A赤●)。腫瘍組織切片の検鏡において、腫瘍に浸潤しているCAR-T細胞(緑)の数が、CD28ζ.CAR-T細胞を移入したCD80発現腫瘍で特に増加していました(図8B右上段)。この結果は、2ndシグナルが増強されたことによる高い殺腫瘍効果は、腫瘍に浸潤したCAR-T細胞に数に起因することを示唆し、臨床的にICB療法の予後良好例で、腫瘍浸潤リンパ球(tumor infiltrated lymphocyte : TIL)が多くみられる知見と一致します。また、実臨床において、第二世代CARは第一世代に比べ複数の利点を持つことが、CARに組み込まれた共刺激分子と、腫瘍に発現する共受容体リガンドの両方に寄与する分子メカニズムが、1細胞1分子イメージング法を用いた解析から解明されたことになります。
分子イメージングの実験から、第二世代CD28ζ.CARの2ndシグナルの本体がPKCθ-NF-κB経路の増強であることが分かりました。また、第一世代ζ.CARでも、CAR-T細胞上に発現する内在性CD28がCD28ζ.CARと同等の2ndシグナルを発信することがわかりました。この結果は、標的腫瘍細胞がCD80/CD86陽性か陰性かによるCAR-T細胞の殺腫瘍効果の違いを示唆し、適応患者の選択、予後予測、各種CAR-T細胞療法の選択など、さまざまな臨床での患者適応の多様性が想像されます。PKCθ-NF-κB経路の解析は生化学的な手法では難しく、分子イメージング法にアドバンテージがあります。また、CAR-T細胞も、従来細胞傷害性T細胞が腫瘍を殺傷するときと同じように、免疫シナプスやマイクロクラスターを形成することが明らかになったことからも、分子イメージングはCAR-T細胞の活性化を客観的かつデジタルに評価する重要な手段となると考えられます。新規の共刺激受容体の導入や、第二世代CARの新規デザインを創造する機会において、またin vivo投与実験前の機能評価など幅広い応用が期待できます。
【論文情報】
タイトル:CD28-mediated linear and parallel costimulatory signaling cooperatively regulate CAR-T cell functions via CAR-CD28 microclusters
著 者:Tetsushi Nishikawa, Arata Takeuchi*, Hiroaki Machiyama, Ei Wakamatsu, Hitoshi Nishijima, Masae Furuhata, Hiroko Toyota, Wataru Nishi, Ryohei Matsushima, Yosuke Yoshida, Kazutoshi Harada, Tadashi Yokosuka*(*責任著者)
掲載誌名:Communications Biology
D O I :https://doi.org/10.1038/s42003-025-08906-y
【用語の解説】
*1:T細胞共刺激受容体
T細胞受容体(TCR)からの1stシグナルが「自己は無視して非自己のみ排除する」という抗原特異性を決定するのに対して、1stシグナルの強度を増強させるT細胞上の受容体の総称。共刺激受容体は複数あり、CD28やICOSなどが知られ、それぞれ結合する相手方(リガンド)がある。CD28にはCD80とCD86の2つのリガンドがあり、結合することでCD28特有の共刺激=2ndシグナルが惹起される。一方1stシグナルを減弱する受容体群を共抑制受容体といい、PD-1やCTLA-4などの免疫チェックポイント分子が相当する。共抑制受容体もそれぞれにリガンドが存在し、結合することで1stシグナルを減弱させたり、もしくはT細胞応答を抑制したりする。
【主な競争的研究資金】
本研究は、文部科学省基盤研究(JP25113725, JP15H01194, JP16H06501, JP17H03600, JP19K22545, JP20H03536, JP23H02775, JP23H04790)、武田科学振興財団の支援を受けています。
本件に関するお問い合わせ先
企画部 広報・社会連携推進室
- 住所
- 〒160-8402 東京都新宿区新宿6-1-1
- TEL
- 03-3351-6141(代)
- d-koho@tokyo-med.ac.jp