【東京医科大学】脳の記憶中枢「海馬」形成の謎を解明 〜早期に運命決定される神経前駆細胞の発見が、発達障害の理解に新たな道筋〜
東京医科大学(学長:宮澤 啓介/東京都新宿区)組織・神経解剖学分野の篠原広志 講師と髙橋宗春 主任教授は、記憶や学習を司る脳の中枢 ー 海馬 ー の形成過程において、これまで知られていなかった「先駆型」の神経前駆細胞集団を世界で初めて発見しました。海馬は記憶や学習に欠かせない脳部位で、その形成メカニズムの解明は、発達障害、認知症、統合失調症、てんかんなどの精神・神経疾患の原因究明につながります。
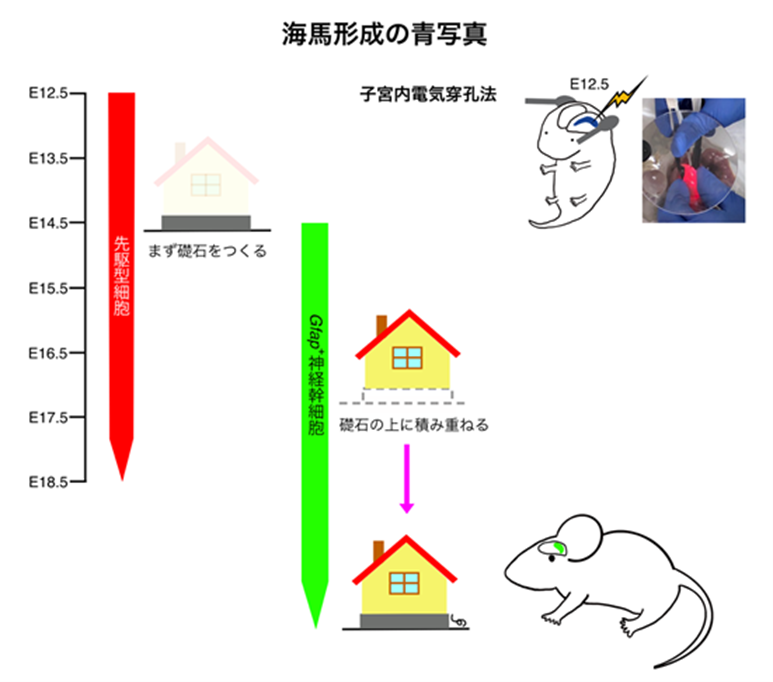
本研究では、篠原講師が長年にわたり試行錯誤を重ねて確立した、マウス胎仔の海馬に直接遺伝子を導入する「子宮内電気穿孔法」により、胎生12.5日目という極めて早い発生段階で標識した細胞を追跡しました。海馬への遺伝子導入は世界的に困難とされてきましたが、一つひとつの条件を丹念に検証し、ついに安定した手法の確立に成功しました。これにより、従来知られていた神経幹細胞とは異なる振る舞いをする細胞集団(先駆型細胞群)を発見。この細胞群は通常の神経幹細胞よりも速やかに成熟した神経細胞(顆粒細胞)へと分化し、海馬の基本構造を形作る「礎石」のような役割を果たしていることが明らかになりました。
本発見は海馬歯状回の形成メカニズムの一端を明らかにするとともに、今回確立した技術基盤は、海馬発生研究のさらなる展開への扉を開くものです。これらの成果は将来、発達障害やアルツハイマー病などの新たな診断法や治療法開発につながることが期待されます。
本研究は、2025年11月6日付で、国際神経科学専門誌「Cellular and Molecular Neurobiology」に掲載されました。
【本研究のポイント】
●困難を乗り越えた技術革新:長年の試行錯誤の末、世界でも類を見ない精度で海馬歯状回への安定的な遺伝子導入(子宮内電気穿孔法)を実現。さらに遺伝子改変マウスを組み合わせた独自の「二重可視化システム」により、同一個体内で異なる細胞集団の運命を同時に追える技術を確立。
●海馬の「礎石」を築く細胞を発見:胎生12.5日という発生初期に、将来の海馬の土台となる先駆型細胞群を世界で初めて同定。
●二つの細胞群が協働して海馬を構築:速やかに分化する先駆型細胞群(全体の約61%が神経細胞になる)と、後から現れて生涯にわたり神経幹細胞として働き続ける細胞群(約23%のみが神経細胞になる)という、役割の異なる二つの細胞集団の存在を証明。
●発達障害研究の新たな突破口:海馬形成の初期段階を標的とすることで、自閉症スペクトラム障害や統合失調症など、海馬の発達異常が関与する疾患の病因解明への新たな道筋。
【研究の背景】
海馬はアルツハイマー病で最初に障害を受ける部位であり、うつ病やPTSDでも形態・機能異常が報告されています。また、胎児期の海馬形成異常は、てんかんや統合失調症、自閉症スペクトラム障害とも関連することが知られています。しかし、海馬がどのように形成されるかについては、まだ多くの謎が残されていました。
これまでの研究では、遺伝子改変マウスを用いて、既知の遺伝子を発現する細胞だけを追跡する手法が主流でしたが、この方法では「既知遺伝子を発現していない細胞」を見逃してしまうという限界がありました。また、海馬は脳の深部に位置し、その複雑な立体構造から、従来の遺伝子導入技術では狙った細胞を正確に標識することが極めて困難でした。
【本研究で得られた結果・知見】
10年以上の試行錯誤の末、本研究では胎仔の脳の特定部位に直接DNAを導入できる「子宮内電気穿孔法」を、海馬研究に最適化しました。具体的には、電極の角度を1度単位で微調整し、電圧・パルス幅・パルス回数の組み合わせを数百通り試すなど、膨大な条件検討を経て、ようやく再現性のある手法を確立しました。この技術により、特定遺伝子発現に依拠せず、位置と時期だけで海馬細胞を標識できるようになり、これまで見過ごされてきた細胞集団の発見につながりました。さらに、蛍光タンパク質を発現する遺伝子改変マウス(Gfap-GFPマウス)と組み合わせることで、一匹のマウスの中で2種類の細胞集団を同時に可視化する「二重可視化システム」を確立。これにより、以下の重要な細胞群の発見をしました。
●先駆型細胞(E12.5標識細胞):海馬の外側から内側へと移動しながら、速やかに成熟した神経細胞となり、海馬歯状回の基本的な礎石を形成する。
●神経幹細胞(Gfap陽性細胞):ゆっくりと分化し、多くは未分化な状態を保ちながら、生後も神経新生を続ける幹細胞プールを形成する。
【今後の研究展開および波及効果】
本研究で発見された先駆型の神経前駆細胞は、海馬形成の「青写真」を最初に描き始める細胞として、発達障害や精神疾患の新たな治療標的となる可能性があります。特に、胎仔期の環境要因(母体のストレス、感染、栄養状態など)がこの早期分化型細胞にどのような影響を与えるかを解明することで、予防医学的なアプローチの開発にもつながることが期待されます。
さらに重要なことに、本研究で確立した海馬歯状回への子宮内電気穿孔法は、さらなる改良により、より高効率で安定的な細胞標識が可能になりつつあります。研究グループは現在、この技術をさらに発展させ、海馬の特定部位・発生時期だけを狙い撃ちできる次世代技術の開発を進めており、近い将来、海馬研究に革命的な進歩をもたらすことが期待されています。また、この細胞集団を制御する分子メカニズムを解明することで、損傷した海馬を再生する再生医療や、加齢に伴う記憶力低下を改善する治療法の開発にも貢献する可能性があります。
【論文情報】
タイトル:In Utero Electroporation Uncovers an Early‑Differentiating Subset of Dentate Gyrus Progenitors
著 者: Hiroshi M. Shinohara* and Tokiharu Takahashi*(*:責任著者)
掲載誌名:Cellular and Molecular Neurobiology
DOI: https://doi.org/10.1007/s10571-025-01616-3
【主な競争的研究資金】
本研究は、日本学術振興会科研費:16 K18983, 20K07233 (篠原)、東京医科大学ダイバーシティ推進センター:TMUCD-202202, TMUCD-202301, TMUCD-202409 (篠原)の支援を受けて行われました。
本件に関するお問い合わせ先
企画部 広報・社会連携推進室
- 住所
- 〒160-8402 東京都新宿区新宿6-1-1
- TEL
- 03-3351-6141(代)
- d-koho@tokyo-med.ac.jp