昭和医科大学などの研究グループが、腸内細菌由来RNAと機械刺激受容体Piezo1による新しい大腸がん抑制メカニズムを発見
大腸がんは世界で年間約90万人が死亡する主要ながんで、特に先進国で増加が著しく、高脂肪食の影響が強く疑われています。しかし、食事性因子がどのように発がんにつながるのかは十分に解明されていません。
大腸がんで最も特徴的な異常の一つがWnt/β-カテニンシグナル*¹の恒常的活性化であり、腫瘍形成・増殖・予後不良と深く関わっています。Wntシグナルを増幅するLgr5の高発現も腫瘍進展に寄与しますが、これらを効果的に抑える治療法は確立されていません。
一方、近年は「機械刺激(腫瘍の圧力など)」が、がん進展に関わることが注目されています。機械刺激を受容するPiezo1*²は血圧感知や血管新生に関わるイオンチャネルとして広く知られていますが、研究グループはこれまでに糞便中RNAが腸管上皮のPiezo1を活性化し、セロトニンを介した腸蠕動を促進することを明らかにしてきました。しかし、RNAの起源や大腸がんにおけるPiezo1の役割は不明でした。
■研究内容
本研究では、マウス大腸がんモデルや細胞株を用いて、糞便中RNA・胆汁酸・Piezo1シグナルの関係を多角的に解析しました。
1. 糞便中RNAは腸内細菌由来で、FEVs内で保護されて存在
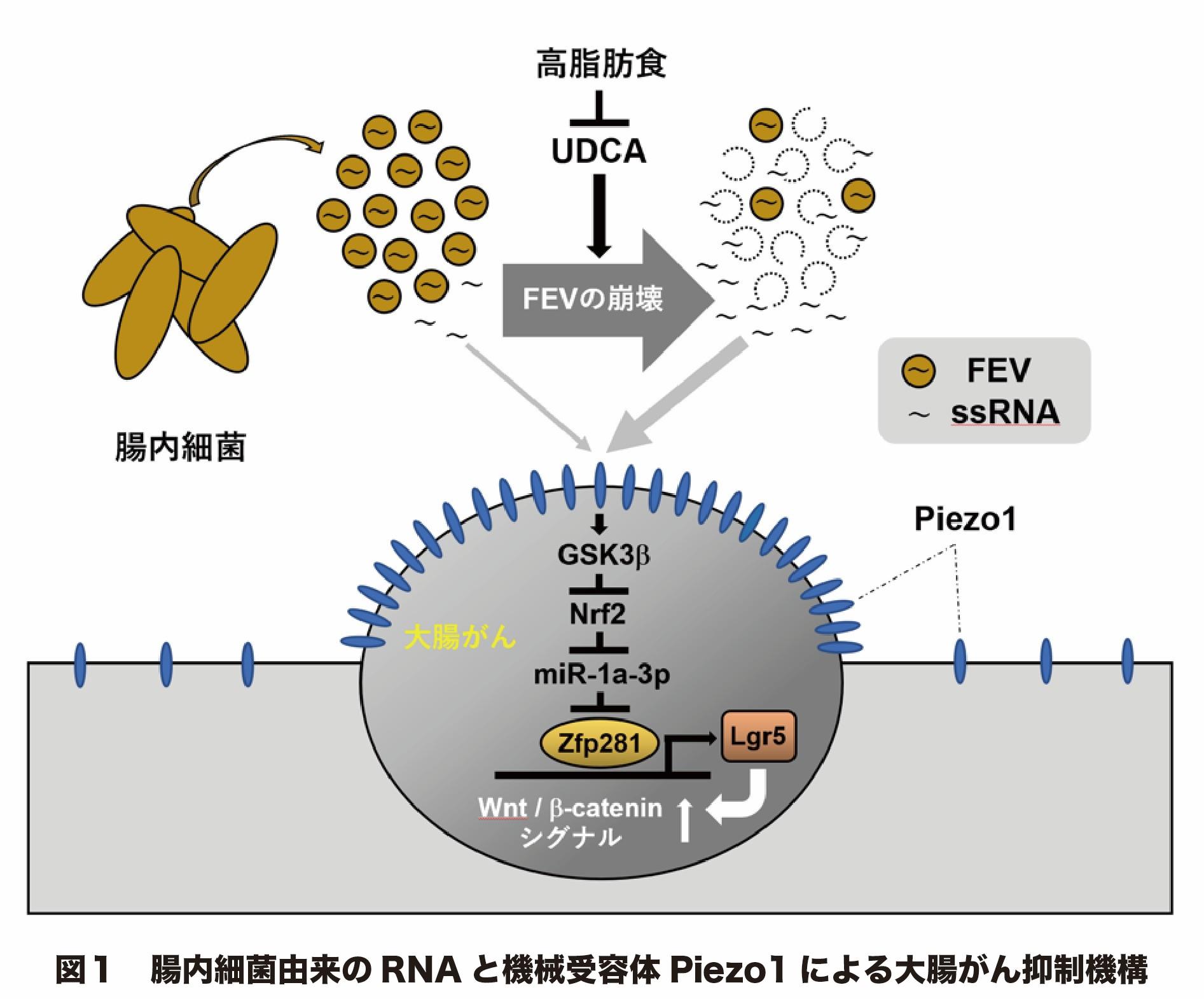
本研究において、糞便中RNAの大部分は腸内細菌由来の細胞外小胞(FEVs)*³内に含有されていることが判明しました。Piezo1活性作用があるRNAが一本鎖RNA(ssRNA)*⁴であることを改めて確認すると同時に、抗生物質などを用いて腸内細菌を除去すると糞便中のRNAが著減することが明らかとなりました。
2. 胆汁酸によるFEVs崩壊と大腸がん抑制
胆汁酸をスクリーニングの結果、UDCA(ウルソデオキシコール酸)*⁵のみがFEVs膜を壊しRNAを放出することを発見しました。これにより、大腸がん細胞のPiezo1が活性化すると癌が抑えられることが明らかとなりました。また、高脂肪食マウスではUDCAが低下し腫瘍数が増加しました。一方、高脂肪食マウスにUDCAを投与すると腫瘍数は減少しました。
3. Piezo1欠損により大腸がんが深刻化する
腸上皮特異的Piezo1欠損マウスにおいて大腸がんを誘発すると、野生型に比べて腫瘍数が著増しました。また、Piezo1欠損大腸がん細胞は増殖・転移能が亢進し、マウス移植実験でも腫瘍増大と生存率低下が確認されました。加えて、ヒト患者データでもPIEZO1低発現は予後不良と相関しました。
4. Piezo1活性化はZfp281を抑制し、Lgr5およびWntシグナルを制御
遺伝子解析から、Zfp28がPiezo1下流で抑制される主要因子であることを特定しました。Zfp281はLgr5発現を誘導する転写因子であり、Lgr5はWntシグナルを介した細胞増殖を促します。そこで、Piezo1/Zfp281ダブル欠損大腸がん細胞を解析したところWnt活性が低下しました。また、Piezo1はmiR-1a-3pの誘導を介してZfp28を抑制する仕組みが明らかになりました。
つまり、「腸内細菌由来RNA → Piezo1活性化 → miR-1a-3p上昇 → Zfp281抑制 → Lgr5低下 → Wntシグナル抑制 → 大腸がん抑制」という新規経路を解明しました(図1)。
■今後の展開
本研究は、腸内細菌由来のssRNAが宿主の機械刺激受容体Piezo1を介して腫瘍進展を抑制する、という従来の常識を覆す新しい概念を提示しました。
また、高脂肪食によりUDCAが低下し、ssRNAがFEVsから放出されず、Piezo1が活性化できなくなると大腸がんが増悪するという新たなメカニズムも示されました。
特に、UDCAは既に臨床で使用されている薬剤であり、腸内ssRNA量を増やしてPiezo1経路を活性化することで、大腸がんの予防・治療への応用が期待されます。
本研究は、「腸内核酸環境」と「機械刺激受容体」のクロストークという新しい視点を提供し、Piezo1を標的とした治療戦略の基盤となる成果です。
■用語説明
*1 Wnt/β-カテニンシグナル
細胞の増殖や幹細胞維持を制御する主要シグナル経路。大腸がんの主要な増悪因子の1つであると考えられている。
*2 Piezo1
機械的刺激を感知するイオンチャネル。Ca²⁺流入を誘導し、血管や腸管などにおいて多様な生理機能を担う。
*3 FEVs(fecal extracellular vesicles:細胞外小胞)
腸内細菌を含め、生細胞が分泌する直径約100~150nmの小胞。分泌細胞由来のRNAやタンパク質を含む。
*4 ssRNA(single-strand RNA: 一本鎖RNA)
微生物やウイルスに由来し、宿主細胞内で免疫応答や代謝経路に影響を与えることがある。
*5 UDCA(ウルソデオキシコール酸)
胆汁酸の一種で、肝機能を改善する薬として用いられる。
■研究成果の公表情報
【論文タイトル】
1 北海道大学 大学院医学研究院、2 昭和医科大学 大学院医学研究科、3 産業技術総合研究所、4 大阪大学 薬学部、5 名古屋市立大学 なごや先端研究開発センター、6 愛知医科大学医学部、7 同等貢献、* 責任著者
【掲載誌】
【研究助成】
▼本件に関する問い合わせ先
昭和医科大学 大学院医学研究科 生体制御学分野 講師
髙山 靖規(たかやま やすのり)
TEL: 03-3784-8110
E-mail: ytakayama@med.showa-u.ac.jp
愛知医科大学 医学部 薬理学講座 教授
丸山 健太(まるやま けんた)
TEL: 0561-63-1161
E-mail: maruyama.kenta.653@mail.aichi-med-u.ac.jp
▼本件リリース元
学校法人 昭和医科大学 総務部 総務課 大学広報係
TEL: 03-3784-8059
E-mail: press@ofc.showa-u.ac.jp